 |
 |

PAGES DU PRATICIEN
Élévation des transaminases chez des adultes sains recevant 4 grammes par jour d'acétaminophèneUn essai contrôlé randomisé
Paul B. Watkins, MD;
Neil Kaplowitz, MD;
John T. Slattery, PhD;
Connie R. Colonese, MS;
Salvatore V. Colucci, MS;
Paul W. Stewart, PhD;
Stephen C. Harris, MD
RÉSUMÉ
 |  |
Contexte Au cours d'un essai clinique portant sur une nouvelle
association hydrocodone/acétaminophène, une forte incidence
d'augmentation des transaminases sériques (ALAT) a été
observée.
Objectifs Caractériser l'incidence et l'amplitude des
élévations d'ALAT chez des participants sains recevant 4 g par
jour d'acétaminophène, seul ou en association avec des
opioïdes définis, par rapport à des participants sous
placebo.
Schéma, cadre et participants: Étude longitudinale
randomisée en simple aveugle, contrôlée contre placebo, de
5 traitements, en groupes parallèles, avec régime alimentaire
contrôlé (repas fournis), réalisée en milieu
hospitalier et incluant 145 adultes sains répartis dans deux
unités de pharmacologie clinique américaines.
Intervention Chaque participant recevait un placebo (n = 39), une
des trois combinaisons acétaminophène/opioïde (n = 80), ou
de l'acétaminophène en monothérapie (n = 26). Chaque
traitement actif incluait 4 g par jour d'acétaminophène,
correspondant à la posologie quotidienne maximale recommandée.
La durée de traitement projetée était de 14 jours.
Principaux critères de mesure Biochimie hépatique et
concentrations minimales d'acétaminophène, mesurées
quotidiennement pendant 8 jours, puis à 1 ou 2 jours d'intervalle.
Résultats Aucun des 39 participants recevant un placebo ne
présentait de pic des ALAT de plus de 3 fois la limite
supérieure de la normale, à la différence des
participants des 4 groupes de traitement avec acétaminophène, y
compris ceux du groupe acétaminophène seul, qui
présentaient une incidence de 31 % à 44 %. Comparé au
placebo, le traitement par acétaminophène était
associé à un pic médian des ALAT visiblement
supérieur (ratio des médianes, 2,78; intervalle de confiance
à 95 %, 1,47-4,09; p < 0,001). Les concentrations minimales
d'acétaminophène ne dépassaient le seuil
thérapeutique chez aucun des participants et, après arrêt
du traitement actif, diminuaient souvent jusqu'à des niveaux
indétectables avant la résolution des élévations
d'ALAT.
Conclusions L'initiation répétée de doses
quotidiennes de 4 g d'acétaminophène chez les adultes sains est
associée à une élévation des taux d'ALAT qui ne
semble pas majorée par un traitement concomitant par opioïde. Les
antécédents d'usage d'acétaminophène doivent
être pris en compte dans le diagnostic différentiel des
élévations des transaminases sériques, même en
l'absence de concentrations mesurables de la substance dans le
sérum.
JAMA. 2006 ; 296 :
87-93.
L' acétaminophène fait partie des analgésiques
en vente libre les plus fréquemment utilisés. Dans le traitement
des douleurs modérées à sévères, les
médecins prescrivent souvent des préparations associant
opioïde et acétaminophène. Ces préparations ont
démontré un bénéfice dans le soulagement de la
douleur et sont considérées comme dénuées de
risque dans la limite des doses recommandées.
Au cours des premières phases de développement d'un nouveau
produit d'association contenant de l'hydrocodone et de
l'acétaminophène, nous avons observé une incidence
étonnamment forte d'élévations des taux d'alanine
aminotransférase (ALAT) sérique chez les participants recevant
le produit d'association à des doses totales quotidiennes contenant 4 g
par jour d'acétaminophène, soit la limite supérieure de
la posologie recommandée (Purdue Pharma L.P., données
disponibles sur demande auprès des auteurs). L'étude a
été interrompue précocement en raison de la
fréquence et de l'amplitude des élévations d'ALAT dans
les groupes de traitement actif comparés au groupe placebo.
Dans la mesure où aucune élévation d'ALAT n'avait
été généralement rapportée chez les adultes
recevant les doses recommandées d'acétaminophène, il a
été suggéré que les opioïdes pouvaient
augmenter la susceptibilité à la toxicité
hépatique de cette substance.
Notre étude a donc été conçue pour
étudier l'hépatotoxicité chez des participants recevant
de l'acétaminophène en monothérapie, des associations
opioïde/acétaminophène, ou un placebo.
MÉTHODES
Dans cette étude (longitudinale, bicentrique, randomisée, en
simple aveugle [participants aveugles au traitement attribué],
contrôlée contre placebo, de 5 traitements en groupes
parallèles), les participants éligibles étaient des
volontaires sains (hommes et femmes) sans potentiel de procréation,
issus de tout groupe ethnique ou racial, et âgés de 18 à
45 ans. Les participants étaient déclarés sains sur la
base de leurs antécédents médicaux, d'un examen physique,
de leurs résultats d'électrocardiogramme et d'analyses
biologiques cliniques (avec résultats négatifs aux analyses
d'urine, de l'antigène de surface du virus de l'hépatite B et
des anticorps anti-VHC). Aucun participant n'est entré dans
l'étude avec un traitement concomitant. La race/ethnicité
était auto-rapportée et le pays d'origine n'était pas
consigné.
|
|

|
|
Figure 1.. Distribution des patients de l'étude.
|
|
|
Le protocole de l'étude a été approuvé par le
comité d'éthique de chaque centre. Les participants ont
donné leur consentement éclairé écrit avant
d'entrer dans l'étude et ont été accueillis dans l'un des
2 centres de recherche clinique pendant toute la durée de l'essai.
Les participants recevaient 1 des 5 régimes thérapeutiques
(définis dans le paragraphe suivant), toutes les 6 heures, par voie
orale, pendant une durée maximale de 14 jours (56 doses), selon un
schéma de randomisation au rapport de 1:1:1:1:1,5. L'attribution du
traitement était effectuée selon un schéma de
randomisation généré centralement, avec une taille de
bloc de 11 participants (Figure
1).
Description des différents traitements
Traitement 1: Percocet, 2 comprimés (7,5 mg d'oxycodone/500 mg
d'acétaminophène; produit du commerce; numéro de lot,
320481NV) plus 2 comprimés placebo (numéro de lot, CB26-06).
Traitement 2: Dilaudid, 2 comprimés (2 mg d'hydromorphone; produit
du commerce; numéro de lot, 03DLT21004), Tylenol Extra Fort, 2 caplets
(500 mg d'acétaminophène; produit du commerce; numéro de
lot, EDA041).
Traitement 3: Deux comprimés de morphine (15 mg; produit du
commerce; numéro de lot, 356926A), Tylenol Extra Fort, 2 caplets (500
mg d'acétaminophène; produit du commerce; numéro de lot,
EDA041).
Traitement 4: Deux comprimés placebo (numéro de lot,
CB26-06), Tylenol Extra Fort, 2 caplets (500 mg
d'acétaminophène; produit du commerce; numéro de lot,
EDA041).
Traitement 5: Deux comprimés placebo (numéro de lot, CB26-06)
plus 2 comprimés placebo (numéro de lot, CB-2003-01).
La biochimie hépatique de routine (bilirubine, aspartate
aminotransférase [ASAT], ALAT, phosphatases alcalines) et
l'alpha-glutathion S-transférase (GST alpha), marqueur d'atteinte
hépatocellulaire, étaient mesurés quotidiennement
jusqu'au 8ème jour. Par la suite, les valeurs biochimiques
étaient mesurées à des jours alternés ou
quotidiennement chez les participants présentant des
élévations (>1 fois la limite supérieure de la normale
[LSN]). Le protocole requérait un arrêt du traitement pour tout
participant ayant des concentrations d'ALAT ou d'ASAT supérieures
à 120 U/L (3 x LSN).
Les évaluations de l'étude incluaient les
événements indésirables, les tests biologiques, les
signes vitaux, et la pharmacocinétique. Les évaluations de fin
d'étude incluaient des analyses biologiques, des examens physiques et
les signes vitaux.
Pharmacocinétique
Les concentrations plasmatiques d'acétaminophène
étaient mesurées quotidiennement chez tous les participants au
creux d'activité du matin, ainsi que sur un intervalle unique entre
deux doses de 6 heures, le troisième jour du traitement (48-54 heures
sous traitement). La série temporelle de concentrations
d'acétaminophène des participants a été
utilisée pour estimer l'aire sous la courbe (48-54 heures), la
concentration maximale (48-54 heures), et le temps nécessaire pour
atteindre la concentration maximale (48-54 heures), par des méthodes
non compartimentales utilisant le logiciel validé de
pharmacocinétique WinNonLin (Pharsight Corp., Mountain View,
Californie).
Régime alimentaire
Le régime alimentaire des participants se composait uniquement de
plats complets préparés standardisés, servis pour le
petit déjeuner, le déjeuner, le dîner et en collation
nocturne. Les participants n'avaient pas accès à des aliments ou
à des boissons autres que ceux fournis. Les calendriers alimentaires
n'ont pas été recueillis.
Analyse statistique
L'analyse de l'impact des opioïdes sur le risque
d'hépatotoxicité de l'acétaminophène a
été effectuée sur une base en intention de traiter
modifiée et axée sur des valeurs longitudinales d'ALAT, d'ASAT
et de bilirubine totale, fournies par un laboratoire central. Un seuil
bilatéral de p < 0,05 était considéré
comme significatif. Toutes les analyses ont été
effectuées à l'aide du logiciel statistique SAS (SAS Institute
Inc., Cary, Caroline du Nord).
Des méthodes descriptives et déductives ont été
appliquées aux paramètres résumés: (1) LabMax (pic
post-traitement de chaque participant); (2) LabRatio (ratio du pic sur valeur
initiale); (3) LabTmax (temps d'obtention du pic observé); (4)
indicateurs binaires de LabMax > K, avec K = 1, 2, 3, 5
ou 8 LSN pour l'ALAT et l'ASAT, et K = 1 ou 1,5 pour la bilirubine
totale.
Après transformation logarithmique, les valeurs LabMax et LabRatio
ont été analysées au moyen d'un modèle d'analyse
de covariance, avec le traitement, le centre et la valeur prétraitement
(jour 1) en effets fixes. Les résultats des modèles
ajustés ont été utilisés pour obtenir des
estimations statistiques non biaisées (avec intervalles de confiance),
par exponentialisation des moyennes des moindres carrés (et de leur
seuil de confiance à 95 %).
Les modèles des LabRatio et LabMax ont également
été utilisés pour tester l'hypothèse nulle
supposant que la réponse moyenne (échelle log) à
l'acétaminophène est invariante dans l'administration
concomitante des opioïdes étudiés. Plus globalement, ces
modèles ont permis de tester toutes les comparaisons appariées
entre les 5 régimes thérapeutiques. Les analyses des pics
incluaient le calcul des intervalles de confiance pour la différence
entre les moyennes arithmétiques de chaque traitement. En
complément de ces analyses basées sur un modèle, des
analyses de sensibilité reposant sur des méthodes non
paramétriques ont été réalisées. Des
procédures diagnostiques, des analyses secondaires et des analyses
exploratrices ont également été effectuées.
En outre, des modèles de régression linéaire
multivariés ont été utilisés pour étudier
la valeur prédictive des variables indépendantes incluant le
traitement, la valeur initiale d'ALAT, l'indice de masse corporelle
(calculé par le poids en kilogrammes divisé par le carré
de la taille en mètres), la race/ethnicité, le centre, les
autres mesures initiales et démographiques, ainsi que les interactions
entre ces facteurs. L'analyse en composantes principales a été
utilisée pour étudier les relations entre les variables de
l'étude.
Les estimations des élévations d'ALAT ont été
obtenues par classification des résultats obtenus pour chaque
traitement (élévations > 1 x, > 2 x, > 3
x, > 5 x, et > 8 x LSN). Pour finir, un test de Fisher
a été appliqué à l'estimation de l'association
entre le régime thérapeutique et l'élévation
d'ALAT.
RÉSULTATS
Sur les 343 participants pré évalués, 147 ont
été randomisés. Deux participants randomisés ont
reçu une dose unique du traitement de l'étude le 1er
jour, avant d'être exclus en raison de résultats positifs aux
tests d'urine. Les 145 participants restants constituaient la population en
intention de traiter modifiée.
Les groupes de traitement formés par les 145 participants de la
population en intention de traiter modifiée étaient similaires
en caractéristiques démographiques
(Tableau 1).
|
|

|
|
Tableau 1.. Caractéristiques de la population de l'étude par groupe de traitement*.
|
|
|
Aucune différence significative dans l'amplitude et l'incidence des
élévations d'ALAT n'a été détectée
dans les groupes recevant les combinaisons de traitement actif. Aucune
différence statistiquement significative n'a été
observée dans les log pic ALAT des différents groupes de
traitement actif. En revanche, la réponse moyenne au placebo
était statistiquement significativement différente par rapport
à celle de chacun des traitements actifs. L'hypothèse nulle
supposant que les traitements actifs ne différent pas du placebo a
été rejetée (p < 0,001). Dans les analyses
exploratrices, l'exposition à un quelconque des traitements avec
acétaminophène était le meilleur facteur prédictif
de réponse élevée d'ALAT.
Seul 1 des 39 participants (3 %) sous placebo a présenté des
taux d'ALAT supérieurs à 2 fois la LSN à un moment
donné de l'étude, et aucun des participants sous placebo n'a
présenté de taux d'ALAT supérieur à 3 fois la LSN
(Tableau 2). En
revanche, dans chacun des 4 groupes de traitement actif, plus de 19 % des
participants ont présenté des taux d'ALAT supérieurs
à 5 fois la LSN. Un profil similaire d'élévations d'ALAT
avec le traitement était observé lorsque les pics ALAT des
participants se normalisaient autour de leur valeur initiale
(Tableau 3). Seul 1 des
39 (3 %) participants recevant un placebo a présenté un pic ALAT
supérieur à 5 fois la valeur initiale, tandis que 29 sur 106 (27
%) participants des groupes de traitement actif ont présenté des
pics ALAT de plus de 8 fois la valeur initiale.
|
|

|
|
Tableau 2.. Incidence des pics d'alanine aminotransférase par multioples de la limite supérieure de la normale*.
|
|
|
|
|

|
|
Tableau 3.. Incidence des pics d'alanine aminotransférase par multiples de la valeur initiale d'alanine aminotransférase des participants*.
|
|
|
Les valeurs d'ALAT individuelles des participants et moyennes des groupes
au cours du temps sont présentées en
Figure 2 pour le groupe
placebo, le groupe de traitement par acétaminophène seul, et
pour les 3 groupes composites de traitement par
opioïde/acétaminophène. Les profils temporels des
élévations d'ALAT étaient similaires dans tous les
groupes de traitement actif, y compris le groupe acétaminophène
seul. Il n'a été observé aucune élévation
d'ALAT de plus de 3 fois la LSN (120 U/L) avant le jour 3 dans chacun des
groupes de traitement. Après arrêt de l'administration de doses
en raison d'élévations d'ALAT de plus de 3 fois la LSN, les taux
d'ALAT ont continué d'augmenter pendant 0 à 4 jours
(médiane, 2 jours) et se sont maintenus à plus de 3 fois la LSN
pendant 1 à 11 jours (médiane, 6,5 jours). Le taux le plus
élevé était de 636 U/L (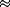 16 x LSN) et a
été observé chez un participant recevant de
l'hydromorphone associé à l'acétaminophène. Dans
le groupe acétaminophène seul, le taux d'ALAT le plus
élevé observé était de 575 U/L ( 16 x LSN) et a
été observé chez un participant recevant de
l'hydromorphone associé à l'acétaminophène. Dans
le groupe acétaminophène seul, le taux d'ALAT le plus
élevé observé était de 575 U/L (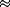 14 x
LSN). 14 x
LSN).
|
|

|
|
Figure 2.. Alanine transférase sérique versus temps dans
l'étude.
|
|
|
Le Tableau 4
présente les estimations statistiques des différences dans les
pics ALAT entre les traitements. Les résultats montrent une
élévation statistiquement significative du pic ALAT
médian dans les groupes de traitement combinant opioïde et
acétaminophène ou de traitement par acétaminophène
seul par rapport au groupe placebo. Les pics ALAT médians pour les
traitements actifs étaient de 2,57 à 3,08 fois supérieurs
à ceux du placebo. En revanche, il n'a pas été
observé de différence statistiquement significative entre les
groupes de traitement actif. Ces résultats ont été
étayés par des résultats comparables obtenus dans une
analyse non paramétrique.
|
|

|
|
Tableau 4.. Comparaison entre traitements du pic d'alanine aminotransférase (LabMax pour l'alanine aminotransférase).
|
|
|
Les élévations d'ASAT étaient
généralement inférieures à celles des ALAT, mais
suivaient une évolution temporelle similaire. Les taux de GST alpha
augmentaient en fonction des valeurs prétraitement chez les
participants avec élévations d'ALAT, et avaient également
un profil temporel similaire (données disponibles sur demande). Les
pics d'ALAT et de GST alpha étaient fortement corrélés
(coefficient de corrélation de Pearson = 0,89; données
disponible sur demande). Il n'a pas été observé
d'anomalies ou de tendances constantes dans la bilirubine totale ou les
phosphatases alcalines, et tous les participants avec élévations
d'ALAT étaient asymptomatiques. Toutes les élévations
d'ALAT significatives se sont résolues après arrêt du
traitement, à l'exception d'un cas dans le groupe morphine plus
acétaminophène qui a été perdu de vue après
le jour 19 (avec des ALAT de 194 le 18ème jour et de 168 le
19ème jour).
Afin de déterminer les caractéristiques des participants
potentiellement associées à l'augmentation de
susceptibilité aux élévations d'ALAT, des analyses
exploratrices ont été effectuées à l'aide d'une
régression linéaire multivariée pour le log pic ALAT. Les
variables indépendantes définies pour le modèle final,
par ordre de significativité statistique nominale décroissante,
étaient le groupe de traitement, le log ALAT initiale, et la
race/ethnicité. Les facteurs prédictifs potentiels
rejetés incluaient les autres caractéristiques initiales et
démographiques. Les résultats de l'analyse exploratrice en
composantes principales concordaient avec ceux du modèle
linéaire.
Sur tous les participants des groupes de traitement recevant de
l'acétaminophène, le risque relatif de pic ALAT supérieur
à 3 fois la LSN pour les Hispano-américains versus non
Hispaniques était de 1,9 (intervalle de confiance à 95 %,
1,1-3,3).
L'AUC (aire sous la courbe) moyenne d'acétaminophène de 48
à 54 heures et la concentration maximale de 48 à 54 heures
étaient comparables pour tous les traitements actifs, et
s'échelonnaient respectivement de 39,0 à 47,2 µg·h/mL
et de 12,6 à 16,7 µg/mL. Aucune différence n'a
été détectée dans les concentrations minimales
moyennes d'acétaminophène, les concentrations maximales ou
l'aire sous la courbe, entre les participants présentant des
élévations d'ALAT (>1 x LSN ou > 3 x LSN) et
ceux sans élévation (données disponibles sur demande).
Chez les participants présentant des élévations d'ALAT de
plus de 3 fois la LSN pendant le traitement, les concentrations
d'acétaminophène diminuaient rapidement après arrêt
de l'administration de doses. En conséquence,
l'acétaminophène était souvent indétectable alors
que les niveaux d'ALAT restaient encore élevés. La
Figure 3 présente
l'évolution temporelle des concentrations
d'acétaminophène, d'ALAT et d'ASAT chez les participants du
groupe acétaminophène seul présentant
l'élévation d'ALAT la plus importante.
|
|

|
|
Figure 3.. Concentrations chez les participants randomisés dans le groupe
acétaminophène seul ayant les pics d'alanine
aminotransférase les plus élevés.
|
|
|
COMMENTAIRES
 |  |
Dans cette étude de 5 groupes, en simple aveugle, randomisée,
contrôlée contre placebo, nous avons trouvé que chacun des
3 traitements opioïde/acétaminophène produisait
fréquemment des élévations d'ALAT. Nous avons
été surpris d'observer que le traitement par
acétaminophène seul, à la dose maximale
recommandée de 4 g par jour, produisait également de
fréquentes élévations d'ALAT. En effet, les
élévations d'ALAT produites par le traitement par
acétaminophène en monothérapie différaient
très peu, en fréquence ou en amplitude, de celles produites par
les associations thérapeutiques
opioïde/acétaminophène. Ces données réfutent
donc le rôle des opioïdes dans les élévations d'ALAT
observées.
En dehors de l'acétaminophène, les causes éventuelles
d'élévation des ALAT n'étaient pas claires. Afin de
minimiser les sources externes de variabilité, tous les participants
ont été placés, pendant l'étude, dans des
unités de pharmacologie clinique, afin qu'ils partagent un même
espace vital et reçoivent des repas préparés et
standardisés. Des élévations d'ALAT
précédemment observées chez des adultes sains recevant un
placebo1 avaient
été attribuées à des variations dans le
régime alimentaire, plus particulièrement entre le régime
standard et le régime à haute teneur calorique riche en apport
glucidique.2
Cependant, dans la présente étude, le régime alimentaire
constitue une explication peu probable des différences observées
dans les élévations d'ALAT entre les groupes de traitement, du
fait que tous les participants recevaient les mêmes repas. Il est
également peu probable qu'un facteur infectieux ou environnemental soit
responsable de ces élévations, compte tenu du nombre
relativement restreint d'élévations observé dans le
groupe placebo de comparaison. Enfin, l'élévation continue des
ALAT pendant 1 à plusieurs jours suivant l'arrêt du traitement et
leur rapide diminution subséquente s'accordent avec la toxicité
hépatique observée après un surdosage chronique
d'acétaminophène.3
Nous concluons donc que les élévations d'ALAT observées
résultent du traitement par acétaminophène à la
dose quotidienne de 4 g.
Aucune association entre la dose thérapeutique
d'acétaminophène et les élévations d'ALAT n'a
été rapportée précédemment. Plusieurs
études4-8
ont mesuré l'ALAT sérique entre les 5ème et
30ème jours suivant l'initiation d'un traitement par
acétaminophène et ont clairement établi que de
très mineures, voire aucune, élévations d'ALAT
étaient observées. Ces études ont inclus diverses
populations de patients généralement âgées. Nous
n'avons trouvé que 3 études publiées portant sur le
traitement quotidien par acétaminophène de jeunes adultes sains,
dans lesquelles l'ALAT sérique était contrôlée
après 5 jours de traitement. Dans la
première,9
l'ALAT était contrôlée << au moins bi-hebdomadairement
>>, lors du traitement de 20 volontaires adultes sains par 4 g par jour
d'acétaminophène. Un seul participant a présenté
une élévation asymptomatique d'ALAT de plus de 4 fois la LSN et
d'ASAT de plus de 15 fois la LSN au jour 16. Bien que les valeurs biologiques
individuelles des autres participants n'aient pas été
communiquées, certaines données dans le manuscrit semblaient
indiquer une augmentation moyenne de l'ALAT entre le jour 4 et le jour 11,
avec un pic à environ 1,5 fois la LSN. Dans la seconde
étude,10
dans laquelle 15 participants sains recevaient quotidiennement 3,9 g
d'acétaminophène pendant 7 jours, "des augmentations
mineures des transaminases (moins de deux fois la normale) ont
été observées (...)". Dans la troisième
étude,11 20
hommes sains recevaient quotidiennement 4,0 g d'acétaminophène
et l'ALAT sérique était contrôlée deux fois par
semaine. Bien que ses variations aient été décrites comme
"globalement (...) mineures", il a été noté
que 2 participants présentaient une élévation
dépassant 4 fois le niveau initial et qu'un autre était sorti de
l'étude sur cette base (ALAT 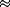 4 x LSN). Ainsi, les
données antérieures de la littérature soutiennent nos
observations quant à la susceptibilité d'un sous-groupe
d'adultes sains à présenter des élévations d'ALAT
lors d'un traitement répété par 4 g par jour
d'acétaminophène. 4 x LSN). Ainsi, les
données antérieures de la littérature soutiennent nos
observations quant à la susceptibilité d'un sous-groupe
d'adultes sains à présenter des élévations d'ALAT
lors d'un traitement répété par 4 g par jour
d'acétaminophène.
L'incidence des élévations d'ALAT observée dans notre
étude d'adultes sains est supérieure à celle
rapportée précédemment dans des études
similaires.9-11
Cela pourrait notamment être lié à la proportion
relativement élevée d'individus hispaniques dans notre
étude, notre analyse exploratrice ayant suggéré que
l'origine hispanique était associée à une
susceptibilité accrue aux élévations d'ALAT. Des
différences ethniques et raciales dans la pharmacocinétique de
l'acétaminophène ont été
rapportées,12,13
mais nous ne connaissons pas d'étude comparant les différences
du métabolisme de l'acétaminophène entre les Hispaniques
et d'autres ethnies. Il a été rapporté des niveaux
initiaux d'ALAT plus élevés chez les Hispaniques que chez les
Caucasiens,14 qui
pourraient être liés à une incidence supérieure de
stéatose hépatique chez les
Hispaniques.15 Bien
qu'une stéatose hépatique puisse rendre plus susceptible
à des anomalies en présence d'acétaminophène,
l'indice de masse corporelle, qui est typiquement élevé chez les
patients avec stéatose hépatique, n'était pas
corrélé avec les élévations d'ALAT dans cette
étude. Il convient cependant de noter que l'indice de masse corporelle
maximum chez les participants de cette étude était de 31, et
qu'en conséquence tous les effets de cette variable peuvent ne pas
avoir été perceptibles. Il semble néanmoins improbable
que la stéatose hépatique ait une grande part de
responsabilité dans la variation de susceptibilité
observée dans notre population.
Le fait que des élévations d'ALAT plus que mineures n'aient
pas été rapportées dans des études impliquant des
populations de patients traités par 4 g quotidiens
d'acétaminophène est inexpliqué. Outre un effet possible
de l'âge, nous suggérons qu'une histoire de traitement
répété par acétaminophène pourrait
réduire la probabilité d'élévations d'ALAT lors
d'une médication ultérieure par cette substance. Un
phénomène similaire a été rapporté avec la
tacrine. Il a été observé que des patients ayant
présenté des élévations d'ALAT au cours d'un
traitement par tacrine avaient une réponse d'ALAT réduite lors
de la réintroduction du médicament, même lorsque le
traitement était initié plusieurs semaines après
l'arrêt de la
substance.16 Les
mécanismes sous-jacents à cette "adaptation" durable
ne sont pas
connus,17 mais nous
pensons qu'elle pourrait expliquer l'incidence réduite
d'élévations d'ALAT dans les populations de patients par rapport
aux participants sains de l'étude.
L'importance clinique des élévations d'ALAT observées
dans notre étude est également peu claire. L'amplitude de ces
augmentations et l'élévation concomitante d'ASAT et de GST alpha
confirment l'origine hépatique de ces enzymes. Un taux d'ALAT de plus
de 3 fois la LSN est typiquement considéré comme cliniquement
significatif et, s'il est confirmé, justifie généralement
de nouvelles recherches d'affection hépatique. En fait, il existe peu
de substances approuvées connues pour produire une
élévation d'ALAT avec une amplitude et une incidence comparables
à celles observées dans cette étude (plus d'un tiers des
participants traités par acétaminophène présentant
des élévations d'ALAT > 3 x LSN). Dans d'autres
contextes, la fréquence et l'amplitude des élévations que
nous avons observées seraient considérées comme un signe
de problèmes potentiels de tolérance hépatique.
Cependant, l'acétaminophène dispose de données de
tolérance nettement favorables dans la posologie recommandée, et
l'innocuité du traitement chronique avec 4 g par jour a
été
confirmée.8,18-21
Nos observations illustrent donc l'existence d'une incertitude quant au
potentiel des élévations des transaminases à
prédire un risque d'affection hépatique grave dans certains cas.
Nous pensons que les élévations d'ALAT observées se
seraient dissipées si l'administration d'acétaminophène
avait été poursuivie, mais cette question devra faire l'objet de
futures études.
Une observation cliniquement importante était que les
élévations d'ALAT survenaient en l'absence de concentrations
plasmatiques d'acétaminophène normalement
considérées comme hépatotoxiques. En effet, au temps
d'obtention du pic des ALAT, les concentrations d'acétaminophène
étaient fréquemment proches ou inférieures aux seuils de
détection. Les concentrations plasmatiques
d'acétaminophène pourraient donc avoir un intérêt
limité dans la recherche d'une relation causale entre les
élévations d'ALAT et les doses thérapeutiques.
Nous concluons que l'initiation, chez les adultes sains, d'un traitement
par acétaminophène à la dose quotidienne maximale
recommandée de 4 g, pendant 4 jours ou plus, génère
fréquemment une augmentation des transaminases sériques, souvent
persistante lorsque les concentrations de la substance ne sont plus
détectables. Un antécédent d'usage
répété d'acétaminophène doit donc
être recherché lors de l'exploration d'élévations
inexpliquées des transaminases sériques, observées dans
la pratique clinique ou au cours d'essais cliniques.
Informations sur les auteurs
Correspondance: Paul B. Watkins, MD, General Clinical Research Center,
Campus Box 7600, Rm 3005 APCF, Chapel Hill, NC 27599-7600
(pbwatkins{at}med.unc.edu).
Contributions des auteurs: le Dr Watkins a eu un accès
complet à toutes les données de l'étude et accepte la
responsabilité de l'intégrité des données et de
l'exactitude de l'analyse des données.
Conception et schéma de l'étude: Watkins, Kaplowitz,
Slattery, Harris, Colonnese.
Recueil des données: Harris, Colonnese.
Analyse et interprétation des données: Watkins,
Kaplowitz, Slattery, Colucci, Stewart, Harris, Colonnese.
Rédaction du manuscrit: Watkins, Colucci, Harris,
Colonnese.
Revue critique du manuscrit: Watkins, Kaplowitz, Slattery,
Colucci, Stewart, Harris, Colonnese.
Analyse statistique: Watkins, Colucci, Stewart, Harris,
Colonnese.
Obtention du financement: Slattery, Harris.
Aide administrative, technique et matérielle:
Colonnese.
Supervision de l'étude: Harris.
Liens financiers: les Drs Watkins, Kaplowitz et Slattery ont
déclaré avoir travaillé comme consultants
rémunérés pour Purdue Pharma L.P. au cours de la
planification et de l'exécution de l'étude, mais n'ont pas
été payés pour la préparation de cet article. Les
fabricants du Tylenol, Dilaudid et Percocet sont McNeil, Knoll et Endo Labs,
respectivement. Les Drs Watkins, Kaplowitz et Stewart ont
déclaré n'avoir jamais eu de liens financiers avec ces
compagnies. Le Dr Slattery a déclaré avoir travaillé
comme consultant pour McNeil. La morphine est un médicament
générique ayant plusieurs fabricants, nous n'avons pas inclus
cette information qui peut être obtenue sur demande.
Analyse statistique indépendante: Paul Stewart, PhD,
professeur de biostatistiques à l'Université de North Carolina
School of Public Health, a eu accès à toutes les données
utilisés pour les analyses primaires rapportées. Il a
réalisé une vérification indépendante des calculs
présentés lors de ces analyses primaires (c'est-à-dire,
le test principal de l'hypothèse nulle avec absence de
différence pour les traitements actifs avec les informatisations des
trois tableaux de cet article qui comprenait l'ensemble des résultats
principaux discutés dans l'abstract, dans la section résultats
et dans la section commentaire de cet article). A la suite de cette
vérification, des corrections mineures ont été faites
concernant les résultats rapportés dans cet article. De plus, en
se basant sur la revue des documents du protocole de l'étude et sur
l'inventaire de toutes les données recueillies dans l'étude, le
Dr Stewart a confirmé que l'ensemble des analyses
présentées dans cet article étaient appropriées et
suffisantes. Le Dr Stewart n'a pas été rétribué
directement pour cette analyse; cependant avec les études en cours de
l'UNC GCRC dans ce domaine, le comité scientifique consultatif du GCRC
a été d'accord que le travail réalisé par le Dr
Stewart devait être considéré comme faisant partie d'un
travail financé par une bourse GCRC (RR000046).
Financement/Soutien: cette étude a été
totalement financée par Purdue Pharma L.P. et a été
menée par deux organisations sous contrat de recherche. Le
contrôle et l'interprétation des données ont
été partagés par tous les auteurs. Le travail du Dr
Stewart a bénéficié du soutien d'une bourse du National
Institutes of Health n° RR-000046.
Rôle du sponsor: le manuscrit soumis originalement a
été revue de façon classique pour une publication chez
Purdue Pharma, mais aucune modification n'a été
suggérée.
Affiliations des auteurs: Department of Medicine, University of
North Carolina, Chapel Hill (Dr Watkins); Keck School of Medicine, Department
of Medicine, University of Southern California, Los Angeles (Dr Kaplowitz);
Departments of Pharmacology and Medicine, University of Washington, Seattle
(Dr Slattery); Boehringer-Ingelheim Pharmaceuticals, Inc, Ridgefield, Conn (Ms
Colonese); Department of Clinical Pharmacology and Clinical Pharmacokinetics,
Purdue Pharma L.P., Stamford, Conn (Mr Colucci and Dr Harris); Department of
Biostatistics, University of North Carolina, Chapel Hill (Dr Stewart).
BIBLIOGRAPHIE
 |  |
1. Rosenzweig P, Miget N, Brohler S. Transaminase elevation on placebo
during phase 1 trials. Br J Clin Pharmacol.1999; 48:19
-23.
PUBMED
2. Purkins L. Love Er, Eve MD, Wooldridge CL, Cowan C, Smart TS,
Johnson PJ, Rapeport WG. The influence of diet upon liver function tests and
serum lipids in healthy male volunteers resident in a phase I unit.
Br J Clin Pharmacol. 2004;57
: 199-208.
PUBMED
3. Prescott LF. Acetaminophen: past, present, and future.
Am J Ther. 2000;7
: 143-147.
PUBMED
4. Falloon I, Watt DC, Lubbe K, MacDonald A, Sheperd M.
N-acetyl-p-amino-phenol (paracetamol, acetaminophen) in the treatment of acute
schizophrenia. Psychol Med. 1978;8
: 495-499.
PUBMED
5. Koennecke HC, Leistner S. Prophylactic antipyretic treatment with
acetaminophen in acute ischemic stroke. Neurology.2001; 57:2301
-2303.
FREE FULL TEXT
6. Seideman P, Melander A. Equianalgesic effects of paracetamol and
indomethacin in rheumatoid arthritis. Br J Rheumatol.1988; 27:117
-122.
FREE FULL TEXT
7. Seideman P, Melander A. Napoxen and paracetamol compared with
naproxen only in coxarthrosis. Acta Orthop Scand.1993; 64:285
-288.
PUBMED
8. Bradley JD, Brandt KD, Katz BP, Kalasinski L, Ryan S. Comparison of
an anti-inflammatory dose of ibuprofen, an analgesic dose of ibuprofen, and
acetaminophen in the treatment of patients with osteoarthritis of the knee.
N Engl J Med. 1991;325
: 87-91.
PUBMED
9. Kwan D, Bartle WR, Walker SE. Abnormal serum transaminases
following therapeutic doses of acetaminophen in the absence of known risk
factors. Dig Dis Sci. 1995;40
: 1951-1955.
PUBMED
10. Lanza FL, Royer GI, Nelson RS, Rack MF, Seckman CE, Schwartz JH.
Effect of acetaminophen on human gastric mucosal injury caused by ibuprofen.
Gut. 1986; 27:440
-443.
FREE FULL TEXT
11. Kwan D, Bartle WR, Walker SE. The effects of acetaminophen on
pharmacokinetics and pharmacodynamics of warfarin. J Clin
Pharmacol. 1999; 39:68
-75.
ABSTRACT
12. Critchley JA, Nimmo GR, Gregson CA, Woolhouse NM, Prescott LF.
Inter-subject and ethnic differences in paracetamol metabolism. Br
J Clin Pharmacol. 1986; 22:649
-657.
PUBMED
13. Yin OQ, Tomlinson B, Chow AH, Chow MS. Pharmacokinetics of
acetaminophen in Hong Kong Chinese subjects. Int J
Pharm. 2001; 222:305
-308.
PUBMED
14. Ioannou GN, Boyko EJ, Lee SP. The prevalence and predictors of
elevated serum aminotransfrase activity in the United States in 1999-2002.
Am J Gastroenterol. 2006;101
: 76-82.
PUBMED
15. Browning JD, Szczepaniak LS, Dobbins R, et al. Prevalence of
hepatic steatosis in an urban population in the United States: impact of
ethnicity. Hepatology. 2004;40
: 1387-1395.
PUBMED
16. Watkins PB, Zimmerman HJ, Knapp MJ, Gracon SI, Lewis KW.
Hepatotoxic effects of tacrine administration in patients with Alzheimer.
JAMA. 1994; 271:992
-998.
FREE FULL TEXT
17. Watkins PB, Seeff LB. Drug-induced liver injury.
Hepatology. 2006;43
: 618-631.
PUBMED
18. Geba GP, Weaver AL, Polis AB, Dixon ME, Schnitzer TJ. Efficacy of
rofecoxib, celecoxib, and acetaminophen in osteoarthritis of the knee.
JAMA. 2002; 287:64
-71.
FREE FULL TEXT
19. Mortensen ME, Cullen JL. Comment: Hepatotoxicity associated with
chronic acetaminophen administration in patients without risk factors.
Ann Pharmacother. 2002;36
: 1481-1482.
PUBMED
20. Nikles CJ, Yelland M, Del Mar C, Wilkinson D. The role of
paracetamol in chronic pain: an evidencebased approach. Am J
Ther. 2005; 12:80
-91.
PUBMED
21. Williams HJ, Ward JR, Egger MJ, et al. Comparison of naproxen and
acetaminophen in a two-year study of treatment of osteoarthritis of the knee.
Arthritis Rheum. 1993;36
: 1196-1206.
PUBMED
ARTICLE EN RAPPORT
JAMA. 2006;296:9.
Texte Complet
|