 |
 |

Topiramate dans le traitement de la dépendance alcooliqueUn essai randomisé et comparatif
Bankole A. Johnson, DSc, MD, PhD;
Norman Rosenthal, MD;
Julie A. Capece, BA;
Frank Wiegand, MD;
Lian Mao, PhD;
Karen Beyers, MS;
Amy McKay, PharmD;
Nassima Ait-Daoud, MD;
Raymond F. Anton, MD;
Domenic A. Ciraulo, MD;
Henry R. Kranzler, MD;
Karl Mann, MD;
Stephanie S. O'Malley, PhD;
Robert M. Swift, MD, PhD; pour le Topiramate for Alcoholism Advisory Board et le Topiramate for
Alcoholism Study Group
RÉSUMÉ
 |  |
Contexte En théorie, le topiramate peut améliorer
l'habitude de boire des personnes alcoolo-dépendantes en diminuant les
effets de renforcement de l'alcool par la facilitation de la fonction de
l'acide gamma-aminobutyrique et en inhibant les voies glutaminergique du
système cortico-mésolimbique.
Objectif Déterminer si le topiramate est un traitement
sûr et efficace de la dépendance alcoolique.
Schéma, environnement et participants Essai randomisé,
en double-aveugle, et contre placebo, de 14 semaines, chez 371 hommes et
femmes, âgés de 18 à 65 ans, diagnostiqués comme
ayant une dépendance alcoolique, mené entre le 27 janvier 2004
et le 4 août 2006 dans 17 centres américains.
Traitements Jusqu'à 300 mg/jour de topiramate (n=183) ou un
placebo (n=188), associés à une intervention de soutien de
l'observance toutes les semaines.
Principaux critères de jugement Le critère principal
de jugement était le pourcentage auto-déclaré de forte
consommation alcoolique. Les critères secondaires incluaient d'autres
mesures auto-déclarées sur la consommation alcoolique
(pourcentage de jours d'abstinence et nombre de verres par jour)
accompagnés par la mesure en laboratoire de la consommation d'alcool
(plasma 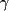 -glutamyltransférase). -glutamyltransférase).
Résultats En considérant toutes les sorties comme
rechutes initiale, le topiramate a été plus efficace que le
placebo pour diminuer le pourcentage de jours de forte consommation alcoolique
entre l'état de base et la 14ème semaine (différence
moyenne, 8.44%; intervalle de confiance à 95%, 3.07%-13.80%; P=0.002).
Une analyse prédéfinie de modèles mixtes montrait aussi
que le topiramate par rapport au placebo diminuait le pourcentage de jours de
forte consommation alcoolique (différence moyenne, 16.19%; intervalle
de confiance à 95%, 10.79%-21.60%; P<0.001) et de tous les
critères concernant la consommation (P<0.001 pour toutes les
comparaisons). Les effets secondaires qui ont été plus
fréquents avec le topiramate par rapport au placebo, respectivement,
incluaient les paresthésies (50.8% vs 10.6%), les modifications du
goût (23.0% vs 4.8%), l'anorexie (19.7% vs 6.9%), et la
difficulté de concentration (14.8% vs 3.2%).
Conclusion Le topiramate est un traitement prometteur de la
dépendance alcoolique.
Trial Registration
clinicaltrials.gov
Identifier: NCT00210925
JAMA.
2007;298(14):1641-1651
En théorie, le topiramate, un dérivé
fructopyranose avec substitution sulfamate, peut diminuer le renforcement
alcoolique et la propension à
boire.1
Le topiramate pourrait agir en réduisant la libération de la
dopamine mésolimbique par l'intermédiaire d'au moins deux
processus pharmacologiques principaux. Ceux-ci incluent la facilitation de la
fonction de l'acide 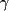 -aminobutyrique par un site non
benzodiazépinique sur le récepteur A de l'acide -aminobutyrique par un site non
benzodiazépinique sur le récepteur A de l'acide
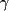 -aminobutyrique 2 et l'antagonisme de l'activité du glutamate au
niveau des récepteurs de l'acide -aminobutyrique 2 et l'antagonisme de l'activité du glutamate au
niveau des récepteurs de l'acide
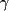 -amino-3-hydroxy-5-méthylisoxazole-4 -- propionic et
kaïnate.1 -amino-3-hydroxy-5-méthylisoxazole-4 -- propionic et
kaïnate.1
Les preuves initiales qui montrent que le topiramate peut améliorer
l'habitude de boire chez les personnes alcoolo-dépendantes proviennent
d'un essai antérieur, monocentrique, en double-aveugle,
randomisé et comparatif ayant eu un schéma différent et
une durée plus
courte.3
Nous avons cherché, dans une étude multicentrique,
randomisée et comparative de 14 semaines, à déterminer
l'efficacité du topiramate (jusqu'à 300 mg/jour) par rapport
à un placebo dans le traitement de personnes
alcoolo-dépendantes, recevant hebdomadairement un traitement
comportemental avec un manuel pour renforcer l'observance au traitement de
l'étude et au protocole du traitement (Brief Behavioral Compliance
Enhancement Treatment, BBCET).
METHODES
Participants
Nous avons inclus 371 hommes et femmes ayant un diagnostic de
dépendance alcoolique selon la définition du Diagnostic and
Statistical Manual of Mental Disorders, Fourth Edition
(DSM-IV),4
à l'aide de l'entretien clinique structuré du
DSM-IV.5
Les participants étaient recrutés dans 17 centres aux
Etats-Unis entre le 27 janvier 2004 et le 4 août 2006, par
l'intermédiaire des journaux, de la radio, de la
télévision et de publicités. Nous avons inclus des
participants, âgés de 18 à 65 ans, qui buvaient 35 verres
ou plus (hommes) par semaine et 28 verres ou plus (femmes) par semaine,
mesurés par un suivi 6 réalisé au cours d'une
période de 28 jours précédant la consultation de
dépistage et destinée à déterminer
l'éligibilité dans l'étude et durant une période
de 7 jours entre la consultation de dépistage et la randomisation. Un
verre standard ou de référence contenait 0.5 oz d'alcool pur,
équivalent à 10 oz de bière, 4 oz de vin, ou 1 oz de
liqueur à
100%.7 Les
participants devaient avoir (1) un score de 8 ou plus au Test Alcohol Use
Disorders Identification
Test,8 qui
évaluait les effets négatifs personnels et sociaux après
consommation d'alcool; (2) un indice de masse corporelle (IMC)
supérieur à 18 (calculé par le poids en kilogramme
divisé par la taille en mètres carrés); et (3) un
dépistage urinaire négatif pour les opiacés, la
cocaïne, les amphétamines, les antidé-presseurs, les
propoxyphènes, et les barbituriques au moment de la randomisation et
avant le début de la période en double aveugle à la
semaine 0. Les participants ayant un dépistage urinaire positif pour le
tétrahydrocannabinol ou des benzodiazépines au cours de la
semaine avant la randomisation (semaine-1) pouvaient être inclus s'ils
avaient un test urinaire négatif lors du nouveau test, 7 jours plus
tard, et répondaient à tous les autres critères
d'inclusion. Bien que tous les participants aient été des
buveurs actifs lors de l'inclusion, ils devaient, pour être inclus,
exprimer le désir de stopper ou de diminuer leur consommation d'alcool,
avec comme objectif à long terme une abstinence.
Nous avons exclus les participants qui (1) avaient un diagnostic
psychiatrique actuel Axis I au DSM-IV autre qu'une dépendance à
l'alcool, la nicotine, ou la caféine; (2) avaient des
antécédents au cours des 6 derniers moins d'abus ou de
dépendance à des drogues, à l'exclusion de la
dépendance à l'alcol, la nicotine, ou la caféine; (3)
avaient des symptômes de manque cliniquement signficatifs (revised
Clinical Institute Withdrawal Assessment for Alcohol scale [CIWAAr] 9 score
>10); (4) avaient fait plus de 4 tentatives formelles ayant
échoué en tant que patient hospitalisé pour diminuer la
dépendance à l'alcool; (5) suivaient une psychothérapie
formelle pour un trouble psychiatrique autre que la dépendance à
l'alcool au cours des trois mois avant la visite d'inclusion; (6) prenaient
des antipsychotiques, antiépileptiques, des stabilisateurs de l'humeur,
des inhibiteurs de l'anhydrase carbonique, des antalgiques opiacés ou
des corticoïdes par voie générale au moment de la visite
d'inclusion (une période de wash-out, selon le profil
pharmacocinétique du [des] traitement [s], était permise); (7)
avaient une dépression cliniquement significative, définie par
un score supérieur à 24 sur l'échelle de cotation de
Montgomery-Asberg
(MADRS)10 ou
basée sur l'impression de médecin de l'étude; (8) avaient
des idées suicidaires au cours des 30 jours à partir de la
semaine 0, vérifiées par les antécédents
médicaux ou un score supérieur à 4 sur
l'élément 10 (idées suicidaires) de la MADRS, ou avaient
essayé de se suicider au cours de la même période; (9)
avaient reçu un traitement pour dépendance alcoolique autre que
les Alcooliques Anonymes; (10) avaient une pathologie médiale
cliniquement significative (c'est-à-dire, à l'examen clinique,
à l'enregistrement électrocardiographique, à
l'évaluation hématologique, à l'examen de la biochimie
incluant la bilirubinémie et à l'analyse urinaire); (11) avaient
des antécédents ou une atteinte rénale évolutive
(c'est-à-dire, clairance à la créatinine <60 ml/min),
calculs rénaux, convulsions, ou hypertension instable; (12) avaient des
troubles neuro-dégénératifs progressifs ou des troubles
neurologiques cliniquement significatifs dont des convulsions; (13)
étaient enceintes ou allaitaient; (14) prenaient des traitements qui
pouvaient modifier la consommation de l'alcool ou un inhibiteur de l'anhydrase
carbonique; (15) avaient été obligés de recevoir un
traitement pour dépendance alcoolique pour éviter un
emprisonnement, une liberté conditionnelle ou une mise en probation ou
la perte d'un travail; ou (16) étaient du même foyer familial
qu'un autre participant à l'étude.
L'approbation pour cette étude avaient été
donnée par les comités de revue institutionnels des 17 centres
participants et les avaient donné leur consentement
éclairé écrit.
Evaluations
Nous avons évalué les participants lors du dépistage
(début de la semaine -1; environ 7 jours avant la randomisation) sur
(1) l'éligibilité médicale pour répondre aux
critères d'inclusion; (2) les caractéristiques de boisson au
cours des 28 jours précédents à l'aide du suivi de ces 28
jours; (3) l'humeur dépressive à l'aide de la MADRS; (4) la
concentration en alcool de l'haleine; et (5) les traitements concomitants. Un
agenda enregistrant la consommation d'alcool était aussi
distribué aux participants à ce moment-là. Les
participants revenaient pour une visite différente à la fin de
la semaine -1 pour compléter le processus de dépistage, qui
incluait l'évaluation (1) de la santé physique (par un examen
clinique, un électro-cardiogramme, les signes généraux
[pression artérielle, pouls et IMC], les tests hématologiques et
biochimiques, les tests urinaires [dont le dépistage urinaire des
drogues], et un test de grossesse chez les femmes en âge de
procréer; (2) des symptômes de manque (CIWA-Ar); (3) de l'humeur
dépressive (MADRS); (4) des effets négatifs personnels et
psychosociaux de l'alcool (Alcohol Use Disorders Identification Test); (5) des
traitements concomitants; (6) des effets indésirables; et (7) de la
concentration en alcool de l'haleine. Les participants ne pouvaient pas donner
de consentement éclairé écrit sauf si leur concentration
en alcool de l'haleine était inférieure à 0.02%.
Au cours de la période en double aveugle entre les semaines 0
à 14, les participants étaient évalués
hebdomadairement par les mesures de consommation (mesurée par le suivi
temporel à l'aide d'un journal comme aidemémoire); les signes
vitaux (dont l'IMC); les symptômes de manque à l'aide de la
CIWA-Ar; les traitements concomitants; l'observance au traitement (ie,
[comprimés distribués - comprimés
rapportés]/nombre total de comprimés prescrits); les effets
secondaires et la concentration d'alcool dans l'haleine. Les participants ne
pouvaient pas compléter les évaluations au cours de la
période en double aveugle sauf s'ils avaient une concentration d'alcool
dans l'haleine inférieure à 0.04%. A chaque visite hebdomadaire
au cours des semaines 0, 4, 8, 12, et 14, nous avons évalué le
topiramate sérique et les taux plasmatiques de la
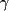 -glutamyltransférase
(GGT).11 Les
GGT plasmatiques étaient utilisées comme biomarqueurs mesurant
la diminution de la boisson car ils ont été largement
acceptés, validés et proportionnés dans le rapport de
l'essai antérieur
monocentrique.3
Ils ont été choisis car la mesure de l'autre biomarqueur commun
(carbohydrate deficient transferrin) pouvait être confondu avec la perte
de poids attendu sous topiramate. Les dépistages hématologiques
et biochimiques incluant les tests urinaires de grossesse étaient
répétés aux semaines 0, 4, 8, 10, 12, et 14. La
dépression était mesurée par la MADRS toutes les deux
semaines de la semaine 0 à 14. -glutamyltransférase
(GGT).11 Les
GGT plasmatiques étaient utilisées comme biomarqueurs mesurant
la diminution de la boisson car ils ont été largement
acceptés, validés et proportionnés dans le rapport de
l'essai antérieur
monocentrique.3
Ils ont été choisis car la mesure de l'autre biomarqueur commun
(carbohydrate deficient transferrin) pouvait être confondu avec la perte
de poids attendu sous topiramate. Les dépistages hématologiques
et biochimiques incluant les tests urinaires de grossesse étaient
répétés aux semaines 0, 4, 8, 10, 12, et 14. La
dépression était mesurée par la MADRS toutes les deux
semaines de la semaine 0 à 14.
Les participants classaient leur race selon 4 possibilités : blancs,
noirs, asiatiques ou autre. Cette information était recueillie pour
permettre une comparaison avec les autres études concernant la
diversité raciale au sein de l'échantillon. Aucune analyse en
fonction de la race n'a été programmée ou
menée.
Procédures
Les participants continuant à répondre aux critères
d'éligibilité de consommation alcoolique après la
période de sélection de 7 jours étaient randomisés
selon un rapport 1:1 vers topiramate ou le placebo selon un code
généré par informatique. La randomisation était
équilibrée à l'aide de blocs de permutation. Les
participants et les investigateurs restaient dans l'aveugle de la
randomisation thérapeutique. Pour conserver l'aveugle, des enveloppes
scellées contenant l'identification du traitement à
l'étude étaient fournies aux investigateurs, qui avaient pour
instruction de ne l'ouvrir qu'en cas d'urgence thérapeutique
spécifique en sachant la randomisation thérapeutique des
participants. La permission devait aussi être obtenue du sponsor avant
l'ouverture de l'enveloppe. Mais aucun incident n'est survenu.
Le traitement à l'étude était distribué en
double aveugle pour la période de détermination de
l'efficacité, qui commençait au début de la semaine 0 et
finissait au début de la semaine 14. Le dose de médicament
était titre du début de la semaine 0 à la fin de la
semaine 5 (c'est-à-dire, au début de la 6ème semaine) et
maintenue du début de la semaine 5 au début de la semaine 14. La
titration était terminée par des augmentations
programmées du nombre de comprimés de topiramate ou un nombre
équivalent de comprimés de placebo
(TABLEAU 1). Les participants
devaient arriver à une dose minimale de topiramate de 50 mg/jour ou
d'équivalent placebo pour rester dans l'essai. Des semaines 14 à
16, les participants diminuaient leur traitement à l'étude pour
des raisons de sécurité. Le topiramate et le placebo
étaient fournis par Ortho-McNeil Janssen Scientific Affairs LLC
(Raritan, New Jersey).
|
|

|
|
Tableau 1.. Plan d'augmentation des doses du Topiramatea
aLes groupes placebo et topiramate ont reçu le même
nombre de comprimés; les comprimés de placebo étaient
inactifs.
bLes semaines représentent le départ d'une semaine
au commencement de la semaine suivante. La fin de l'étude était
le commencement de la semaine 14.
|
|
|
Tous les participants recevaient un BBCET en tant que traitement
psychosocial. Une procédure brève, standardisée,
(réalisée en environ 15 minutes), de renforcement de
l'observance psychosociale, le BBCET, mettait l'accent sur le fait que
l'observance au traitement était cruciale pour modifier le comportement
des participants visà-vis de la boisson. De courtes
interventions,12
comme le BBCET, ont démontré un bénéfice dans le
traitement de la dépendance alcoolique. Le BBCET a été
modélisé sur une prise en charge clinique de la pathologie lors
de l'essai réalisé en collaboration sur la dépression du
National Institute of Mental Health, qui l'a utilisé en tant
qu'addition au traitement pharmacologique dans cette
étude.13
De même, le BBCET a été utilisé avec
réussite comme plateforme de traitement psychosocial dans l'essai
antérieur sur l'efficacité du topiramate pour traiter la
dépendance
alcoolique.3
Des praticiens formés, dont des infirmières cliniciennes,
administraient le BBCET avec un manuel chaque semaine au cours de la
période en double aveugle. L'uniformité et la constance de
l'administration du BBCET étaient vérifiées par une
supervision de la formation et de l'application, incluant une
évaluation par une sélection randomisée d'environ 10% des
sessions enregistrées sur bande audio dans tous les centres par le
superviseur de l'étude BBCET (N.AD.). Le manuel BBCET peut être
obtenu auprès de l'investigateur principal (B.A.J.)ou le livre qui le
contient.14
Résultat et évaluation de la tolérance
Le critère principal d'efficacité était le pourcentage
de jours de forte consommation alcoolique (nombre de jours pour lesquels les
hommes consommaient plus de 5 verres standards par jour et les femmes plus de
4 verres standards par jour divisé par le nombre de jours de
l'étude).
Les critères secondaires de jugement incluaient les autres mesures
auto-rapportées sur la boisson (pourcentage de jours d'abstinence ;
calculé par le nombre de jours sans boisson divisé par le nombre
de jours de l'étude); les verres par jour de boisson (moyenne de 14
verres par semaine par le ratio de jours de boisson; défini comme le
nombre de verres consommés au cours d'une semaine donnée
divisé par le nombre de jours de boisson au cours de cette semaine) ;
et la mesure biologique de la consommation d'alcool (GGT plasmatiques).
Nous avons évalué la tolérance à l'aide des
signes généraux (pression artérielle, pouls,
température et IMC), des tests hématologiques et biochimiques
(incluant les tests de la fonction hépatique [aspartate
aminotransférase et alanine aminotransférase], bicarbonates et
pH), l'humeur dépressive (MADRS), les symptômes de manque
(CIWA-Ar), les traitements concomitants, l'observance au traitement, la
concordance du taux de topiramate entre la dose et le taux
sérique(relation entre la dose assignée de topiramate et son
taux sérique), la rétention, la concentration en alcool de
l'haleine et les effets indésirables.
Un comité indépendant des données se réunissait
périodiquement pour s'assurer de la tolérance chez les
participants.
Calculs de puissance
Nous avons estimé la puissance statistique pour cette étude
sur la base des données d'une étude antérieure
monocentrique, en double aveugle, de 12 semaines, dans laquelle il y avait une
reduction significative du pourcentage de jours de forte consommation pour le
topiramate vs placebo (moyenne [DS], 42.9% [28.2%] vs 31.4% [25.2%],
respectivement).3
Pour être conservateur, le DS le plus large était utilise dans
le calcul de la taille de l'échantillon. De plus, il était
anticipé que cette étude multicentrique aurait plus de
variabilité que le précédent essai mono-centrique. Aussi,
la DS utilise dans le calcul de la taille de l'échantillon a
été augmenté de 20% de 28.2% à 33.9%. Sur la base
d'un test t pour deux échantillons, nous avons déterminé
qu'une taille d'échantillon de 184 participants dans les groupes
topiramate et placebo (au total, 368 participants) serait nécessaire
pour obtenir une puissance de 90% pour détecter une différence
moyenne de groupe 11.5% en pourcentage de jours de forte consommation à
un niveau de signification bilatéral de 0.05.
Plan d'analyse statistique
Approches générales. Nous avons géré les
données selon les recommandations de la International Conference on
Harmonisation sur les bonnes pratiques cliniques. Des points individuels ont
été vérifiés pour des valeurs inhabituelles et
pour l'ensemble. Les valeurs d'efficacité ont été
validées comme étant corrects contre des rapports de cas. Des
comparaisons déductives ont été effectuées pour la
réponse et moyennées durant toute la phase en double aveugle
sauf indication contraire. Pour tous les tests statistiques, les
différences entre les groupes de traitement ont été
considérées comme significatives si elles atteignaient un taux
de 0.05 aux tests bilatéraux. Pour l'analyse principale, le test
déductif était mené chez tous les participants
randomisés. Pour les analyses prédéfinies, le test
déductif était effectué chez tous les participants
randomisés étant revenus pour au moins une visite en double
aveugle et ayant reçu au moins une dose de traitement. Les
données ont été analysées avec la version 9.1 SAS
(SAS Institute Inc, Cary, Caroline du Nord). La durée de la phase en
double aveugle (semaines 0-14) a été calculée comme la
date de la première dose en double aveugle plus un jour à la
date de la dernière dose en double aveugle mais avant la période
de deux semaines durant laquelle les participants diminuaient le traitement
à l'étude.
|
|

|
|
Figure 1.. Profil de l'essai
Les personnes ayant terminé l'étude étaient les
participants qui avaient achevé les 14 semaines de traitement en
double-aveugle. Les échecs d'inclusion ont été ceux qui
avaient reçu un traitement après le début de la semaine 1
mais n'étaient pas revenus à la visite pour d'autres
évaluations.
|
|
|
Analyse des résultats et mesures de la tolérance.
L'hypothèse nulle pour le critère principal d'efficacité
était qu'il n'y aurait pas de différence entre le topiramate et
le placebo pour le pourcentage moyen de jours de forte consommation au cours
de la phase en double aveugle. Pour l'analyse principale, nous avons
testé l'hypothèse nulle sur le pourcentage de jours de forte
consommation chez tous les participants randomisés en imputant les
données de toutes les sorties comme rechutes à la mesure
initiale (données de la période de 7 jours avant de prendre la
première dose du traitement à la semaine 0). Ce modèle
d'analyse primaire a été fait pour donner l'estimation plus
conservatrice de la différence d'effet du traitement entre le
topiramate et le placebo. Nous avons aussi testé l'hypothèse
nulle chez tous les patients randomisés qui prenaient au moins une dose
du traitement à l'étude et avaient eu au moins une visite en
double aveugle, sans imputer les données manquantes pour les sorties
(analyse prédéfinies). Pour les deux approches, nous avons
analysé le pourcentage de jours de forte consommation à l'aide
d'un modèle avec des mesures répétées comprenant
le groupe de traitement, le centre, la semaine, le sexe, le pourcentage
initial de jours de forte consommation, l'âge chronologique, l'âge
au début du problème alcoolique et le traitement x interaction
semaine comme covariables. Une matrice de covariance non structurée a
été utilisée pour modéliser les
corrélations entre les mesures répétées des
participants. Les moyennes des moindres carrés et leurs intervalles de
confiance à 95% (IC) ont été dérivés pour
chaque groupe de traitement; IC 95% ont été calculés pour
la différence des moyennes des moindres carrés entre les groupes
de traitement.
Un statisticien indépendant validait l'analyse des données
pour la mesure des critères. Le statisticien indépendant testait
aussi l'hypothèse nulle pour le critère principal
d'efficacité (pourcentage de jours de forte consommation) à
l'aide d'une méthode de pondération avec probabilité
inverse15
afin de déterminer si le modèles mixte à mesures
répétées rendait compte de façon adéquate
du taux d'attrition différentielle entre les groupes topiramate et
placebo. Dans cette méthode, les données des participants
étaient pondérées par la probabilité inverse de
terminer la phase en double aveugle. Ces prédictions, basées sur
un modèle de risque pour les sorties chaque semaine, étaient
présumées dépendre de facteurs recueillies avant cette
semaine. En particulier, notre modèle dépendait du groupe de
traitement, du centre, de l'âge chronologique, de l'âge au
début du problème alcoolique, du sexe, du pourcentage de jours
à forte consommation au cours de la semaine précédente et
de son interaction avec le traitement, du nombre moyen
d'événements indésirables du système nerveux
central au cours de la semaine précédente.
Nous avons utilisé une procédure de test multiple à
séquence fixe pour contrôler une erreur de type 1 en
déterminant le moment le plus précoce où la
différence entre les pourcentages des deux groupes des jours de forte
consommation deviendrait statistiquement significatif et serait maintenu pour
les autres temps de mesures ultérieurs. L'approche de l'analyse
primaire imputant toutes les données manquantes aux valeurs de base
pour donner une série complète de données, nous avons
utilisé une analyse de covariance pour tester la différence
entre les groupes. La procédure a été utilisée
pour tester la différence entre les pourcentages des deux groupes des
jours de forte consommation à la semaine 14 à un niveau de
signification de 0.05 (bilatérale). S'il y avait une différence
significative à la semaine 14, cette procédure était
répétée pour les semaines précédentes
jusqu'au point où il n'y aurait plus de différence.
L'observation d'absence de différence à la semaine 14 aurait
stoppé la comparaison des semaines précédentes. Les
données secondaires sur la boisson auto-rapportées et les GGT
ont été analysées pour fournir un tableau plus complet
des résultats. Les mesures secondaires aut-rapportées sur la
boisson (pourcentage de jours d'abstinence et nombre de verres par jour de
boisson) ont été analysées comme le critère
principal d'efficacité. Les GGT ont été analysées
sous la forme du rapport logarithmique incrémentiel avec le temps,
comme dans l'étude
antérieure.3
Toutes les analyses ont été menées à l'aide de la
méthode imputant les données manquantes aux données de
départ (approche analytique primaire) et le modèle mixte
incluant des mesures répétées prédéfinies,
qui n'imputait pas les données manquantes. Nous avons estimé le
risque relatif d'atteindre 28 jours ou plus d'abstinence continue et 28 jours
ou plus continus de consommation moins importante à l'aide d'un
modèle des hasards proportionnels de Cox. Les covariables candidates
pour le modèle des risques proportionnels de Cox étaient les
mêmes que ceux utilisés pour l'analyse des mesures
répétées. De plus, à l'aide de la méthode
de Kaplan-Meier, nous avons calculé la fonction de probabilité
cumulée d'atteindre 28 jours ou plus d'abstinence cumulée de
consommation moins importante pour le topiramate et le placebo. Nous avons
comparé les fonctions de probabilité cumulée à
l'aide du test du log-rank. Toutes les analyses étaient menées
à l'aide de la méthode d'imputation des données
manquantes dans les valeurs de départ (approche analytique primaire) et
l'analyse prédéfinie, qui n'imputait pas les données
manquantes. Nous avons comparé la différence des scores des
mesures de tolérance entre les groupes topiramate et placebo, à
l'exception de la concordance pour le topiramate dose-sérum, à
l'aide d'un modèle simple des mesures répétées des
deux groupes. En comparaison, la concordance pour le topiramate
dose-sérum a été analyse par une analyse de
régression, et une relation entre le taux sérique de topiramate
et le pourcentage de jours de forte consommation chez ceux qui avaient
terminé la semaine 14 était examiné à l'aide d'une
corrélation de Pearson. Les données descriptives des mesures de
tolérance sont rapportées qualitativement.
Taux d'erreur de type 1. Nous avons testé les
différences entre traitements sur un nombre de mesures
auto-rapportées sur la boisson et la mesure biologique vérifiant
la consommation d'alcool. En se basant sur le fait que ces mesures
étaient fortement corrélées, nous attendions peu
d'inflation du taux d'erreur de type 1. En fait, la corrélation de
Pearson entre la mesure d'efficacité primaire, le pourcentage de jours
de forte consommation et les autres mesures auto-rapportées de
consommation (verres par jour de consommation et pourcentage de jours
d'abstinence) allait de 0.65 à 0.85 (P<0.001). Les
corrélations bivariées du pourcentage de jours de forte
consommation et les autres mesures auto-rapportées de consommation ont
été estimées à l'aide des données de
départ. Ainsi qu'il a déjà été
décrit antérieurement, en testant les différences entre
traitement avec le temps pour chaque mesure, nous avons appliqué une
procédure de tests multiples à séquence fixe pour
contrôler le taux d'erreur de type 1.
|
|

|
|
Figure 2.. Pourcentage de jours de forte consommation à partir de la semaine
d'étude 1
Les barres d'erreur indiquent l'erreur standard. A, l'approche analytique
primaire d'imputer les données manquantes avec les valeurs de
départ est illustrée ici. La comparaison entre les participants
prenant le placebo et le topiramate est devenue statistiquement significative
à la fin de la semaine 4 (P<0.001). B, L'approche
prédéfinie de ne pas imputer les données manquantes est
illustrée ici; Les données ont été
analysées à l'aide d'un modèle mixte de mesures
répétées. La comparaison entre les participants prenant
le placebo et le topiramate est devenue statistiquement significative à
la fin de la semaine 2 (P=0.04).
|
|
|
|
|

|
|
Figure 3.. Délai jusqu'au premier jour de 28 jours continus ou plus
d'abstinence
A, L'approche analytique primaire d'imputer les données manquantes
avec les données de départ est illustrée ici; les
chiffres observés de participants dans le groupe topiramate
répondant à ce critère ont été de 27 sur
183 par rapport à 6 à 188 dans le groupe placebo. B, L'approche
prédéfinie de ne pas imputer les données manquantes est
illustrée ici; Les chiffres observées de participants dans le
groupe topiramate répondant à ce critère ont
été de 27 sur 179 par rapport à 6 sur 185 dans le groupe
placebo. L'analyse primaire n'a pas ce nsuré d'observation; en
comparaison, l'analyse prédéfinie aurait pu censurer une(des)
observation(s) la semaine de sortie d'étude.
|
|
|
|
|

|
|
Figure 4.. Délai jusqu'au premier jour de 28 jours continus ou plus de
consommation moins importante
A, L'approche analytique primaire d'imputer les données manquantes
avec les données de départ est illustrée ici; les
chiffres observés de participants dans le groupe topiramate
répondant à ce critère ont été de 54 sur
183 par rapport à 28 à 188 dans le groupe placebo. B, L'approche
prédéfinie de ne pas imputer les données manquantes est
illustrée ici; Les chiffres observées de participants dans le
groupe topiramate répondant à ce critère ont
été de 54 sur 179 par rapport à 28 sur 185 dans le groupe
placebo. L'analyse primaire n'a pas censuré d'observation; en
comparaison, l'analyse prédéfinie aurait pu censurer une(des)
observation(s) la semaine de sortie d'étude.
|
|
|
Il est à noter que les différences entre traitement, pour une
des mesures quelconques ci-dessus, restaient fortement significatives
même lorsque nous avons appliqué la procédure à
étapes de tests multiples de Hochberg pour contrôler le taux
d'erreur de type 1, avec l'hypothèse très conservatrice que ces
mesures étaient indépendantes.
RESULTATS
Nous avons randomisé 183 participants dans le groupe topiramate et
188 participants dans le groupe placebo (N=371;
FIGURE 1). Les participants des
deux 2 groupes avaient des caractéristiques de départ similaires
(TABLEAU 2).
|
|

|
|
Tableau 2.. Caractéristiques initiales démographiques et
psychopathologiques
Abréviation: CIWA-Ar, revised Clinical Institute Withdrawal
Assessment for Alcohol scale.
aSauf indication contraire.
bLes participants qui sélectionnaient "autre"
étaient requis de spécifier. Des 14 du groupe topiramate, 13 se
sont identifiés comme latino-américains et 1 comme cubain. Des
10 du groupe placebo, 8 se sont auto-identifiés comme
latino-américains, 1 espagnol et 1 améridien.
cReflète les valeurs moyennes au cours de la
période de 28 jours précédant la visite de
dépistage (Début de la semaine-1). Toutes les autres valeurs
réfèrent à la valeur de départ (Semaine 0).
|
|
|
Pour l'analyse primaire, le pourcentage de jours de forte consommation, en
imputant les données pour toutes les sorties comme rechutes avec les
mesures de départ, le topiramate par rapport au placebo a
diminué de façon plus importante le nombre de jours de forte
consommation entre la ligne de départ et la semaine 14 (d'une moyenne
de [DS] de 81.91% [20.04%] à 43.81% [40.43%] pour le topiramate vs
81.97% [19.92%] à 51.76% [37.43%] pour le placebo; différence
moyenne, 8.44% [IC 95%, 3.07%-13.80%];P=0.002). Une différence entre
les groupes est apparue à la semaine 4
(FIGURE 2A). Pour les mesures
secondaires auto-rapportées de consommation et les marqueurs
biologiques, à l'aide de la méthode primaire analytique
d'imputation des sorties comme rechutes dans les valeurs de départ, le,
topiramate était plus efficace que le placebo
(TABLEAU 3).
|
|

|
|
Tableau 3.. Différence entre le placebo et le topiramate pour les mesures
auto-rapportées de consommation et les marqueurs biologiques de
consommation.
Abréviations: IC, Intervalles de confiance ; GGT, gamma-glutamyl
transférase.
aLes valeurs montrées sont les chiffres non
ajustés.
bLes valeurs ont été calculées des moyennes
des moindres carrés pour la différence dans l'effet du
traitement entre le topiramate et le placebo moyenné pour l'ensemble de
la période en double aveugle.
cLes données auto-rapportées sur la consommation
réfèrent aux valeurs collectées au cours de la semaine
précédente. Un participant randomisé dans le groupe
placebo avait des données manquantes pour toutes les données de
consommation. Pour ce participant, les valeurs de départ de
consommation ont été imputées comme la moyenne des
valeurs de la consommation pour tous les autres participants randomisés
dans le groupe placebo. Trois participants avaient des données
manquantes pour les GGT de départ. Pour ces participants, leurs taux
plasmatiques des GGT ont été imputes à l'aide des valeurs
prédictives par un modèle de régression linéaire
dérivé de tous les autres participants randomisés. Ce
modèle inclut le groupe de traitement, le centre, l'âge
chronologique, l'âge au début du problème de boisson, le
sexe et le pourcentage de jours de forte consommation.
dCalculé et analysé comme
précédemment rapporté.3Le rapport était le (log
GGT à un moment donné- log GGT de départ)/log GGT de
départ. Au départ, le log du rapport GGT est simplement le
logarithme de la valeur des GGT. Plus négative est la valeur à
la fin de l'étude, meilleur est la réduction par rapport au
départ.
eLes données auto-rapportées sur la consommation
alcoolique se réfèrent aux valeurs recueillies au cours de la
semaine précédente.
|
|
|
Pour l'analyse prédéfinie du pourcentage de jours de forte
consommation, sans imputation des données manquantes pour les sorties,
le topiramate était plus efficace que le placebo pour améliorer
le pourcentage de jours de forte consommation (différence moyenne,
16.19% [IC 95%, 10.79%-21.60%]; P<0.001). Une différence entre les
groupes est apparue la semaine 2 (Figure
2B). Pour les mesures secondaires auto-rapportées de
consommation alcoolique et les marqueurs biologiques de consommation, à
l'aide de l'analyse prédéfinie, le topiramate était
supérieur au placebo (Tableau
3). La méthode de pondération inverse
réalisée par le statisticien indépendant sur le
critère primaire d'efficacité (pourcentage de jours de forte
consommation) montrait des résultats similaires (différence
moyenne à la semaine 14, 18.80% [IC 95%, 10.38%-27.12%]; P<0.001).
Des différences significatives entre le topiramate et le placebo sont
cependant apparues plus précocement au cours de la semaine 2 pour le
modèle mixte prédéfini par rapport à la semaine 4
avec la méthode de pondération inverse.
Par rapport aux receveurs du placebo, les receveurs du topiramate ont eu
des réductions significatives non seulement dans les mesures
auto-rapportées mais aussi pour les GGT (P<0.001 pour toutes les
comparaisons; Tableau 3).
A l'aide de l'approche primaire analytique d'imputation des données
manquantes avec les valeurs de départ, le topiramate par rapport au
placebo a été associé à un taux significativement
plus élevé d'obtention de 28 jours continus ou plus de
consommation moins importante (RR, 2.28 [IC 95%, 1.44-3.59]; P<0.001) et de
28 jours continus ou plus d'abstinence (RR, 5.03 [IC 95%, 2.07-12.20];
P<0.001).
A l'aide de l'approche prédéfinie de non imputation des
données manquantes, le topiramate par rapport au placebo a
été associé à un taux significativement plus
élevé d'atteindre 28 jours continus ou plus de consommation
moins importante (RR, 2.79 [IC 95%, 1.76-4.42]; P<0.001) et de 28 jours
continus ou plus d'abstinence (RR, 5.96 [IC 95%, 2.46-14.46]; P<0.001).
Les estimations de Kaplan-Meier de la fonction de probabilité
cumulée d'atteindre 28 jours continus ou plus d'abstinence sont
montrées dans la FIGURE
3A en imputant les données et dans la
Figure 3B sans les
données imputées. Avec les deux approches, le groupe topiramate
a atteint 28 jours continus ou plus d'abstinence significativement plus
rapidement que le groupe placebo (log-rank P<0.001 pour les deux
approches).
Les estimations de Kaplan-Meier de la fonction de probabilité
cumulée d'atteindre 28 jours continus ou plus de consommation moins
importante sont montrées dans la
FIGURE 4A en imputant les
données et dans la Figure
4B sans les données imputées. Avec ces deux
approches, le groupe topiramate a atteint 28 jours continus ou plus de
consommation moins importante significativement plus rapidement que le groupe
placebo (log-rank P<0.001 pour les deux approches).
En ce qui concerne les mesures de tolérance à la fin de
l'étude, le groupe topiramate par rapport au groupe placebo group a
été associé à une diminution des enzymes
hépatiques (différence moyenne pour l'aspartate
aminotransférase, 4.70 [IC 95%, 1.86-7.54] et différence moyenne
pour l'alanine aminotransférase, 6.74 [IC 95%, 2.99-10.49]) et à
une diminution de l'IMC (différence moyenne, 1.08 [IC 95%, 0.81-1.34;
P<0.001). Bien que les bicarbonates plasmatiques aient été
significativement plus faibles dans le groupe topiramate par rapport au groupe
placebo (différence moyenne, 2.50 mmol/l [IC 95%, 1.89-3.11 mmol/l];
P<0.001), ceci n'a pas nécessité d'intervention
médicale. Le niveau du PH plasmatique n'a pas été
différent entre les groupes (données non montrées). Aucun
autre test hématologique ou biochimique n'a été
différent entre les deux groupes (données non montrées).
Les deux groupes n'ont pas été différents pour l'humeur
dépressive (différence moyenne, 0.57 [IC 95%, -0.13 à
1.26]; P=0.11) ou pour l'humeur générale (différence
moyenne, 0.80 [IC% 95%, -2.52 à 4.12]; P=0.63).
D'une manière générale, les scores de manqué
évalués par la CIWA-Ar ont été excessivement bas
et n'ont pas différé entre les groupes topiramate et placebo
(différence moyenne, 0.01 [IC 95%, -0.31 à 0.33]; P=0.94). Peu
de participants ont rapporté avoir fréquenté les
rencontres des Alcooliques Anonymes (5.0% pour le groupe topiramate et 2.7%
pour le groupe placebo). Les taux d'utilisation de traitements concomitants
dans les groupes topiramate et placebo groups ont été
respectivement de 88% et 95.7%. Les pourcentages suivants de participants ont
reçu ces doses de topiramate ou de placebo, respectivement, 0-25 mg
(3.8%, 1.6%), 25-50 mg (8.2%, 0.5%), 50-100 mg (12%, 3.2%), 100-150 mg (10.4%,
6.9%), 150-200 mg (13.7%, 10.1%), et 200-300 mg (50.8%, 77.7%).
Les taux d'observance au traitement ont été similaires
à 91.46% (DS, 14.96%) pour ceux sous topiramate par rapport à
90.09% (DS, 13.12%) pour ceux sous placebo. La moyenne (DS) de la dose de
topiramate a été de 171.4 (107.6) mg et le taux sérique
de 4.8 (3.7) µg/ml. Il y a eu une relation prévisible et
significative entre la dose de topiramate administrée et la
concentration sérique obtenue (r=0.71; P<0.001). Il n'y a eu
cependant aucune corrélation significative entre le taux de topiramate
sérique et le pourcentage de jours de forte consommation chez ceux
ayant atteint la semaine 14 (r=0.04; P=0.72). Les échantillons obtenus
à différents temps pour les taux sériques hebdomadaires
de topiramate ont contribué à une certaine variabilité
des résultats. Aucune différence chiffrée n'a
été observée entre les groupes topiramate et placebo pour
la concentration moyenne en alcool de l'haleine; la lecture moyenne a
été de 0.002%. Les taux de rétention à la fin de
l'étude chez les patients randomisés ont été de
61.2% (112 sur 183) dans le groupe topiramate et de 76.6% (144 sur 188) dans
le groupe placebo (P<0.001). Les taux d'attrition en raison des effets
indésirables ont été de 18.6% (34 sur 183) dans le groupe
topiramate et de 4.3% (8 sur 188) dans le groupe placebo (P<0.001).
Les effets indésirables rapportés survenus chez 10% ou plus
des participants ont été les paresthésies, les
céphalées, les anomalies du goût, la fatigue, l'anorexie,
les nausées, les insomnies, les difficultés de concentration et
d'attention, la nervosité, les troubles de la mémoire, la
somnolence, la diarrhée, des sinusites, de la dyspepsie, des blessures,
des vertiges, des symptômes grippaux, du prurit et des myalgies
(TABLEAU 4); Tous à
l'exception des céphalées, des nausées, des sinusites, de
la dyspepsie, des blessures, des symptômes grippaux et des myalgies ont
été plus fréquents dans le groupe topiramate que dans le
groupe placebo. Quatre participants dans chaque groupe de traitement ont eu un
effet indésirable sévère. Dans le groupe topiramate, un
participant a développé une myopie et un autre une lithiase
cholédocienne. Un participant a eu des convulsions et une perte de
conscience, mais ceci n'a pu être attribué au traitement à
l'étude. En comparaison, dans le groupe placebo, un participant est
décédé d'un arrêt cardiaque associé à
une hémorragie gastro-intestinale et des convulsions. L'indicent
déclen-cheur n'a pu être déterminé. Trois personnes
différentes du groupe placebo ont eu une fracture du plateau tibial,
des taux d'enzymes anormalement élevés et une diverticulite.
|
|

|
|
Tableau 4.. Evénements indésirables au cours du traitement chez 10% ou
plus des participantsa
aSi un participant avait un effet indésirable ou plus
dans une catégorie, le participant est comptabilisé une fois
dans cette catégorie. Les participants ayant plus d'une survenue d'un
effet indésirable sont résumés dans la catégorie
la plus proche. Le dictionnaire modifié des effets indésirables
de la World Health Organization pour le topiramate (version 1992, 3rd quarter)
a été utilisé pour le codage.
bCalculé à l'aide du test du
chi2.
|
|
|
COMMENTAIRE
 |  |
Le topiramate a été significativement plus efficace que le
placebo pour diminuer le nombre de jours de forte consommation alcoolique,
pour améliorer les autres critères auto-rapportés de
consommation et pour diminuer les GGT au sein d'une population
hétérogène et géographiquement diverse de
personnes alcoolo-dépendantes recevant toutes les semaines une BBCET
pour stimuler l'observance au traitement pendant 14 semaines.
La méthode analytique prédéfinie dans cette
étude, un modèle mixte avec des mesures
répétées, fait un ajustement sur les données
manquantes sur la base de la survenue aléatoire. Même si nous
avons utilisé une méthode de pondération inverse pour
montrer la différence des taux de sorties, qui ont été
plus élevés dans le groupe topiramate, ceci a eu peu d'effet sur
le résultat du critère primaire (pourcentage de jours de forte
consommation alcoolique), nous avons rapporté une analyse encore plus
conservatrice en imputant toutes les données manquantes avec les
données de départ comme approche analytique primaire. Ceci a
été fait pour déterminer, et c'est ce que nous pensons,
la limite inférieure absolue de la différence de traitement
entre le topiramate et le placebo. La constance de l'effet
thérapeutique du topiramate a été mise en evidence par la
démonstration de l'efficacité clinique sur le placebo à
l'aide de trois méthodes séparées inférentielles.
Nous proposons que l'effet thérapeutique du topiramate qui
améliore les résultats sur la boisson est probablement dû
à la diversité de son action
pharmacologique.1
Des travaux de recherche complémentaires pour élucider la
combinaison du processus pharmacologique avec l'effet neuro-pharmacologique du
topiramate pourrait, en conséquence, stimuler le développement
de traitements plus puissants.
Indépendamment du modèle statistique, l'effet
thérapeutique du topiramate a été évident
dès la semaine 4 et s'est maintenu tout au long de l'essai. En
conséquence, il serait intéressant sur un plan clinique de
déterminer si une dose plafond de topiramate plus faible que celle
ciblée dans cette étude (dose de topiramate <300 mg/jour)
serait aussi efficace tout au long de la période de l'essai. Dans
l'affirmative, ceci augmenterait l'utilité du topiramate car il existe
une tendance vers une augmentation des effets secondaires avec la dose. De
plus, il serait aussi intéressant de déterminer si des
périodes plus longues de traitement par topiramate seraient
associées à des réductions soutenues ou plus importantes
des fortes consommations d'alcool.
Nos observations fournissent une validation montrant que les personnes
ayant une dépendance à l'alcool, tout en consommant de fortes
quantités d'alcool, peuvent être traitées sûrement
et de façon fiable avec le
topiramate16
(sans arriver à une abstinence avant de commencer le traitement).
Il est plausible que les personnes ayant certains sous-types d'alcoolisme
puissant bénéficier le plus du traitement par topiramate. Alors
que nous n'avons pas observé de réponse différrente au
traitement en fonction de l'âge de l'établissement des
problèmes de boisson, d'autres types de classification par sous-types
qui pourraient inclure la génétique ou d'autres biomarqueurs
pourraient donner d'autres informations.
Notre étude a trois limites. La première, alors que le profil
des événements indésirables était similaire
à celui trouvé dans notre étude
précédente,3
la titration plus rapide a été associée à une
diminution de l'observance à l'étude lors de la prise du
traitement. Antérieurement, lorsque le topiramate était titre
sur une période supplémentaire de 2 semaines (sur 8 semaines
plutôt que sur 6 semaines), les taux de rétention étaient
similaires entre les groupes topiramate et placebo. Les centres cliniques les
moins familiers avec le topiramate ont eu plus de difficultés avec la
rétention, tandis que les taux de complétion de certains groupes
expérimentés ont approché les 90% (données non
montrées). Nous conseillons à nos praticiens d'utiliser une
titration lente et de fournir aux participants une éducation centre sur
la prise en charge des événements indésirables
émergeants pour optimiser l'observance lors de la prise du traitement.
Deuxièmement, comme avec la plupart des essais cliniques dans le
domaine de la dépendance à l'alcool, les participants inclus
devaient répondre à des critères permettant la conduite
d'une étude sûre. Ce type de cohorte est souvent relativement
plus saine et peut-être plus homogène que la population
générale de ceux qui cherchent un traitement de
l'alcoolo-dépendance, notre capacité à
géné-raliser sans restriction cette étude à la
pratique clinique est donc limitée. Troisièmement, cette
étude n'a pas eu de période de suivi, nous ne pouvons donc
déterminer si, combien et à quel intervalle les participants
auraient rechuté à la suite du retrait du traitement.
Néanmoins, par rapport à la façon dont les personnes se
débrouillent, en moyenne, à la suite d'un traitement pour
alcoolisme dans un essai clinique, une méta-analyse des études
récentes a montré que, même après un seul
événement thérapeutique, la plupart peuvent avoir des
réductions substantielles de la boisson jusqu'à un
an.17
Nos observations dans cette étude montrant que le topiramate est un
traitement sûr et efficace de l'alcoolo-dépendance, sont
scientifiquement et cliniquement importantes. L'alcoolisme est classé
en troisième et cinquième positions sur le fardeau
américain et global des maladies. La découverte d'agents
pharmacologiques comme le topiramate qui améliorent les critères
de consommation alcoolique peut apporter une contribution majeure à la
santé globale. La pharmacothérapie du topiramate peut être
associée à une courte intervention administrable par des
professionnels de santé non spécialistes, une étape
suivante serait d'examiner son efficacité dans un contexte pratique
communautaire.
Informations sur les auteurs
Correspondance : Bankole A. Johnson, DSc, MD, PhD, Department of
Psychiatry and Neurobehavioral Sciences, University of Virginia, POBox 800623,
Charlottesville, VA 22908
(bankolejohnson{at}virginia.edu).
Une liste complete du Groupe d'étude Topiramate for Alcoholism
Advisory Board and the Topiramate for Alcoholism est indiqué
à la fin de l'article.
Contributions des auteurs : Le Dr Johnson a eu un accès
complet à toutes les données de l'étude et accepte la
responsabilité de l'intégrité des données et de
l'exactitude de l'analyse des donées. Les Drs Anton, Ciraulo, Kranzler,
Mann, O'Malley, et Swift ont contribué à parts égales
comme co-auteurs.
Conception et schéma de l'étude : Johnson,
Rosenthal, Capece, Beyers.
Recueil des données : Johnson, Capece, Wiegand, Beyers,
McKay, Ait-Daoud, Anton, Ciraulo, Kranzler, O'Malley, Swift.
Analyse et interprétation des données : Johnson,
Rosenthal, Capece, Wiegand, Mao, Ait-Daoud, Anton, Ciraulo, Kranzler, Mann,
O'Malley, Swift.
Rédaction du manuscrit: Johnson, Rosenthal.
Revue critique du manuscrit : Johnson, Capece, Wiegand, Mao,
Beyers, McKay, Ait-Daoud, Anton, Ciraulo, Kranzler, Mann, O'Malley, Swift.
Analyse statistique : Johnson, Rosenthal, Wiegand, Mao.
Obtention du financement : Johnson, Rosenthal, Capece,
Wiegand.
Aide administrative, technique et matérielle : Johnson,
Capece, Wiegand, Beyers, McKay, Ait-Daoud, Anton, Ciraulo, Kranzler, Mann,
O'Malley, Swift.
Supervision de l'étude: Johnson, Rosenthal, Capece, Wiegand, McKay,
Ait-Daoud.
Liens financiers : Le Dr Johnson déclare avoir
été consultant de Ortho-McNeil Janssen Scientific Affairs LLC,
Organon, et TransOral Pharmaceuticals Inc. Les Drs Rosenthal, Wiegand, Mao, et
McKay et Mss Capece et Beyers déclarent être salariés
d'Ortho-McNeil Janssen Scientific Affairs LLC. Le Dr Ait-Daoud déclare
être consultant d'Ortho-McNeil Janssen Scientific Affairs LLC. Le Dr
Anton déclare avoir reçu des honoraires de consultation
d'AstraZeneca, Axis Shield, Cephalon, DrugAbuse Sciences, Sanofi-Aventis, Eli
Lilly, et Solvay Pharmaceuticals; des honoraires de consultant et des
honoraires de Forest Laboratories et Alkermes Inc; des honoraires de
consultation et des bourses de Bristol-Myers Squibb, Hythiam, et Pfizer; et
des honoraires de consultation, des honoraires et des bourses de Contral
Pharma/Biotie Pharmaceuticals et Ortho-McNeil Janssen Scientific Affairs LLC.
Le Dr Ciraulo déclare avoir reçu des honoaires de consultation
et des contrats d'essais cliniques de Janssen, Bristol-Myers Squibb, et
d'Ortho-McNeil Janssen Scientific Affairs LLC; des honoraires de consultation
de Cephalon; et des contrats d'essais cliniques d'Alkermes Inc, AstraZeneca,
Drug Abuse Sciences, Lipha, UCB Pharma, et Catalyst Pharmaceutical Partners.
Le Dr Kranzler déclare avoir travaillé comme consultant et
d'avoir reçu un soutien pour ses recherches d'Alkermes Inc,
Ortho-McNeil Janssen Scientific Affairs LLC, Bristol-Myers Squibb, Forest
Pharmaceuticals, et Drug Abuse Sciences; d'avoir travaillé comme
consultant pour Elbion, Sanofi-Aventis, and Solvay Pharmaceuticals. Le Dr Mann
déclare avoir reçu des honoraires de consultation et des
contrats d'essais cliniques d'Alkermes Inc, Janssen, Sanofi-Aventis, Pfizer,
Lipha Pharmaceuticals, Ortho-McNeil Janssen Scientific Affairs LLC, et Forest
Pharmaceuticals. Dr Le O'Malley déclare avoir travaillé comme
consultant et d'avoir reçu un soutien à ses recherches de
Alkermes Inc, GlaxoSmithKline, Ortho-McNeil Janssen Scientific Affairs LLC, et
Pfizer; d'avoir travaillé comme consultant pour Eli Lilly et Johnson
& Johnson; d'avoir reçu un soutien à ses recherches de Lipha
Pharmaceuticals, Bristol-Myers Squibb, Sanofi-Aventis, et Mallinckrodt; et
d'avoir été remboursé pour des déplacements par
Alkermes Inc. Le Dr Swift déclare avoir travaillé comme
consultant et d'avoir reçu une bourse d'Ortho-McNeil Janssen Scientific
Affairs LLC et Pfizer; d'avoir travaillé comme consultant et pour le
bureau des orateurs pour Cephalon et Forest Laboratories; d'avoir
été consultant pour Alkermes Inc, Organon, et TransOral
Pharmaceuticals Inc; et d'avoir reçu une bourse de US World Meds et
Bristol-Myers Squibb.
Financement/Soutien : Ortho-McNeil Janssen Scientific Affairs LLC a
fourni le traitement et a financé cette étude.
Rôle du sponsor : Le sponsor a été
impliqué à tous les stages du schéma de l'étude
jusqu'à l'interprétation des résultats y compris la revue
critique du manuscrit. Les données ont été
gérées initialement et analysées par Ortho-McNeil Janssen
Scientific Affairs LLC et PharmaNet Inc, une organisation sous contrat de
recherche, et ont été interprétées par les auteurs
de l'étude avec des indications d'Ortho-McNeil Janssen Scientific
Affairs LLC clinical et du personnel des statistiques. Une analyse statistique
indépendante a été réalisée par Daniel O.
Scharfstein, ScD (voir ci-dessous). L'intégralité du premier
manuscrit a été préparée par le Dr Johnson. Le
manuscrit a été revu par tous les auteurs, qui l'ont
discuté en groupe à un meeting défini du Topiramate for
Alcoholism Advisory Board (Voir ci-dessous) à New York le 2
février 2007. Les changements de style et de présentation et
aucun changement des résultats ou de leur interprétation n'ont
été faits par le sponsor par rapport au manuscrit initial ou aux
résultats présentés à ce meeting.
Analyse statistique indépendante : Daniel O. Scharfstein,
ScD, a conduit une analyse statistique indépendante au Johns Hopkins
University Bloomberg School of Public Health. Le Dr Scharfstein a eu
accès à toutes les données brutes et au plan
prédéfini pour l'analyse des données. Le Dr Scharfstein a
confirmé la précision et la validité des données
et des résultats présentés dans cet article. Il a
été rémunéré par Ortho-McNeil Janssen
Scientific Affairs LLC pour réaliser cette évaluation
statistique indépendante.
Groupe d'étude Topiramate for Alcoholism (par investigateur
principal et centre participant par ordre alphabétique) : Nassima
Ait-Daoud, MD (University of Virginia, Charlottesville), Robert M. Anthenelli,
MD (University of Cincinnati, Cincinnati, Ohio), Raymond F. Anton, MD (Medical
University of South Carolina, Charleston), Marianne Guschwan, MD (New York
Veterans Affairs Medical Center, New York), Bankole A. Johnson, DSc, MD, PhD,
MPhil, FRCPsych (University of Texas Health Science Center, San Antonio),
Henry R. Kranzler, MD (University of Connecticut, Farmington), Sandra C.
Lapham, MD (Behavioral Health Research Center of the Southwest, Albuquerque,
New Mexico), Francis Levin, MD(Columbia University, New York, New York), Lance
Longo, MD (Aurora Sinai Medical Center, Milwaukee, Wisconsin), F. Gerard
Moeller, MD (University of Texas Health Science Center, Houston), Stephanie S.
O'Malley, PhD (Yale University, New Haven, Connecticut), Helen M. Pettinati,
PhD (University of Pennsylvania, Philadelphia), Ihsan Salloum, MD, MPH
(University of Pittsburgh, Pittsburgh, Pennsylvania), Ofra Sarid-Segal, MD
(Boston University, Boston, Massachusetts), Robert M. Swift, MD, PhD (Brown
University, Providence, Rhode Island), Richard P. Trautman, MD(University of
Oklahoma, Oklahoma City), and Roger D. Weiss, MD (McLean Hospital, Belmont,
Massachusetts).
Conseil scientifique Topiramate for Alcoholism (par ordre
alphabétique) : Giovanni Addolorato, MD (Catholic University, Rome,
Italy), Nassima Ait-Daoud, MD (University of Virginia, Charlottesville),
Raymond F. Anton, MD (Medical University of South Carolina, Charleston),
Domenic A. Ciraulo, MD(Boston University, Boston, Massachusetts), Carlo C. Di
Clemente, PhD (University of Maryland, Baltimore County), Scott E. Hemby, PhD
(Wake Forest University, Winston-Salem, North Carolina), Eric Hollander, MD
(Mount Sinai School of Medicine, New York, New York), Bankole A. Johnson, DSc,
MD, PhD, MPhil, FRCPsych (University of Virginia, Charlottesville), Falk
Kiefer, MD (University Hospital of Hamburg, Hamburg, Germany), Henry R.
Kranzler, MD (University of Connecticut, Farmington), Otto M. Lesch, MD
(Medical University of Vienna, Vienna, Austria), Robert J. Malcolm Jr, MD
(Medical University of South Carolina, Charleston), Karl Mann, MD (University
of Heidelberg, Mannheim, Germany), Stephanie S. O'Malley, PhD (Yale
University, New Haven, Connecticut), et Robert M. Swift, MD, PhD (Brown
University, Providence, Rhode Island).
Autres Contributions : Le personnel des centres participants a
apporté une aide technique précieuse et
expérimentée.. Robert H. Cormier Jr, BA, et Chamindi
Seneviratne, MD, ont apporté une aide à la préparation de
ce manuscrit. Mr Cormier et Dr Seneviratne sont employés par
l'University of Virginia et ont été
rémunérés pour leur aide sous la forme de leurs salaires
habituels.
Affiliations des auteurs : Department of Psychiatry and
Neurobehavioral Sciences, University of Virginia, Charlottesville;
Ortho-McNeil Janssen Scientific Affairs LLC, Raritan, New Jersey; Department
of Psychiatry and Behavioral Sciences, Medical University of South Carolina,
Charleston; Division of Psychiatry, Boston University, Boston, Massachusetts;
Department of Psychiatry, University of Connecticut, Farmington; Department of
Addictive Behavior and Addiction Medicine, University of Heidelberg, Mannheim,
Germany; Department of Psychiatry, Yale University, New Haven, Connecticut;
Department of Psychiatry and Human Behavior, Brown University, Providence,
Rhode Island.
BIBLIOGRAPHIE
 |  |
1. Johnson BA. Recent advances in the development of treatments for
alcohol and cocaine dependence: focus on topiramate and other modulators of
GABA or glutamate function. CNS Drugs.2005; 19(10):873
-896.
PUBMED
2. White HS, Brown SD, Woodhead JH, Skeen GA, Wolf HH. Topiramate
modulates GABA-evoked currents in murine cortical neurons by a
nonbenzodiazepine mechanism. Epilepsia.2000; 41(suppl 1):S17
-S20.
PUBMED
3. Johnson BA, Ait-Daoud N, Bowden CL, et al. Oral topiramate for
treatment of alcohol dependence: a randomised controlled trial.
Lancet.2003; 361(9370):1677
-1685.
PUBMED
4. American Psychiatric Association. Diagnostic and
Statistical Manual of Mental Disorders. 4th ed. Washington, DC:
American Psychiatric Association; 1994.5. First MB, Spitzer RL, Gibbon M, Williams JBW. Structured
Clinical Interview for DSM-IV Axis I Disorders—Patient Edition
(SCID-I/P, Version 2.0). New York: New York State Psychiatric
Institute, Biometrics Research Department; 1997.6. Sobell LC, Sobell MB. Timeline follow-back: a technique for
assessing self-reported alcohol consumption. In: Litten RZ, Allen JP, eds.
Measuring Alcohol Consumption: Psychosocial and Biochemical
Methods. Totowa, NJ: Humana Press Inc; 1992:41
-72.7. Miller WR, Heather N, Hall W. Calculating standard drink units:
international comparisons. Br J Addict.1991; 86(1):43
-47.
PUBMED
8. Bohn MJ, Babor TF, Kranzler HR. The Alcohol Use Disorders
Identification Test (AUDIT): validation of a screening instrument for use in
medical settings. J Stud Alcohol.1995; 56(4):423
-432.
PUBMED
9. Sullivan JT, Sykora K, Schneiderman J, Naranjo CA, Sellers EM.
Assessment of alcohol withdrawal: the revised Clinical Institute Withdrawal
Assessment for Alcohol scale (CIWA-Ar). Br J Addict.1989; 84(11):1353
-1357.
PUBMED
10. Montgomery SA, Asberg M. A new depression scale designed to be
sensitive to change. Br J Psychiatry.1979; 134:382
-389.
FREE FULL TEXT
11. Conigrave KM, Degenhardt LJ, Whitfield JB, et al. CDT, GGT, and AST
as markers of alcohol use: the WHO/ISBRA collaborative project.
Alcohol Clin Exp Res.2002; 26(3):332
-339.
PUBMED
12. Edwards G, Orford J, Egert S, et al. Alcoholism: a controlled trial
of "treatment" and "advice." J Stud
Alcohol.1977; 38(5):1004
-1031.
PUBMED
13. Fawcett J, Epstein P, Fiester SJ, Elkin I, Autry JH. Clinical
management—imipramine/placebo administration manual: NIMH Treatment of
Depression Collaborative Research Program. Psychopharmacol
Bull.1987; 23(2):309
-324.
PUBMED
14. Johnson BA, DiClemente CC, Ait-Daoud N, Stoks SM. Brief Behavioral
Compliance Enhancement Treatment (BBCET) manual. In: Johnson BA, Ruiz P,
Galanter M, eds. Handbook of Clinical Alcoholism
Treatment. Baltimore, MD: Lippincott Williams & Wilkins;2003
: 282-301.15. Robins JM, Rotnitzky A, Zhao LP. Analysis of semi-parametric
regression models for repeated outcomes in the presence of missing data.
J Am Stat Assoc.1995; 90(429):106
-121.
16. Johnson BA, Ait-Daoud N, Akhtar FZ, Ma JZ. Oral topiramate reduces
the consequences of drinking and improves the quality of life of
alcohol-dependent individuals. Arch Gen Psychiatry.2004; 61(9):905
-912.
FREE FULL TEXT
17. Miller WR, Walters ST, Bennett ME. How effective is alcoholism
treatment in the United States? J Stud Alcohol.2001; 62(2):211
-220.
PUBMED
ARTICLES EN RAPPORT
Cette semaine dans le JAMA
JAMA. 2007;298:1605.
Texte Complet
Médicaments pour traiter la dépendance alcoolique: Une addition au continuum des soins
Mark L. Willenbring
JAMA. 2007;298:1691-1693.
Texte Complet
|