 |
 |

JAMA-EXPRESS
Effet du rimonabant sur la progression de l’athérosclérose chez des patients avec obésité abdominale et maladie coronarienneÉtude contrôlée randomisée STRADIVARIUS
Steven E. Nissen, MD;
Stephen J. Nicholls, MBBS, PhD;
Kathy Wolski, MPH;
Josep Rodés-Cabau, MD;
Christopher P. Cannon, MD;
John E. Deanfield, MD;
Jean-Pierre Després, PhD;
John J. P. Kastelein, MD, PhD;
Steven R. Steinhubl, MD;
Samir Kapadia, MD;
Muhammad Yasin, MD;
Witold Ruzyllo, MD;
Christophe Gaudin, MD;
Bernard Job, MD;
Bo Hu, PhD;
Deepak L. Bhatt, MD;
A. Michael Lincoff, MD;
E. Murat Tuzcu, MD;
Pour les investigateurs STRADIVARIUS
JAMA. 2008;299(13):1547-1560
RÉSUMÉ
 |  |
Contexte L'obésité abdominale est associée à des anomalies métaboliques et à un risque majoré de maladie cardiovasculaire athéroscléreuse. Cependant, aucune stratégie de traitement de l'obésité n'a démontré de capacité à ralentir la progression de la maladie coronarienne.
Objectif Déterminer si la perte de poids et les effets métaboliques du rimonabant, antagoniste sélectif des récepteurs cannabinoïdes de type 1, réduit la progression de la coronaropathie chez les patients présentant une obésité abdominale et un syndrome métabolique.
Schéma, cadre et participants Étude contrôlée contre placebo, randomisée, en double aveugle, en 2 groupes parallèles (inclusions décembre 2004-décembre 2005), comparant le rimonabant à un placebo chez 839 patients de 112 centres d’Amérique du Nord, d’Europe, et d'Australie.
Interventions Les patients recevaient des conseils diététiques et étaient randomisés pour recevoir le rimonabant (20 mg par jour) ou un placebo apparié ; ils subissaient en outre une échographie intracoronaire à l’inclusion (n = 839) et à la fin de l’étude (n = 676).
Principaux critères de jugement Le critère primaire d’efficacité était la variation du pourcentage du volume de l'athérome (PAV) ; le critère secondaire d’efficacité était la variation du volume total normalisé de l'athérome (TAV).
Résultats Dans les groupes rimonabant vs placebo, le PAV (intervalle de confiance [IC] à 95 %) a augmenté de respectivement 0,25 % (-0,04 % à 0,54 %) vs 0,51 % (0,22 % à 0,80 %) (p = 0,22), et le TAV a diminué de 2,2 mm3 (- 4,09 à - 0,24) vs une augmentation de 0,88 mm3 (- 1.03 à 2,79) (p = 0,03). Dans les groupes rimonabant vs placebo, après imputation de données sur la base des caractéristiques initiales pour les patients n’ayant pas achevé l’étude, le PAV a augmenté de 0,25 % (- 0,04 % à 0,55 %) vs 0,57 % (0,29 % à 0,84 %) (p = 0,13), et le TAV a diminué de 1,95 mm3 (- 3,8 à - 0,10) vs une augmentation de 1,19 mm3 (- 0,73 à 3,12) (p = 0,02). Les patients traités par rimonabant ont présenté une réduction supérieure du poids corporel (4,3 kg [- 5,1 à – 3,5] vs 0,5 kg [- 1,3 à 0,3]) et du tour de taille (4,5 cm [- 5,4 à – 3,7] vs 1,0 cm [- 1,9 à – 0,2]) (p > 0,001 pour les deux comparaisons). Dans le groupe rimonabant vs placebo, les taux de HDL (high-density lipoprotein)-cholestérol ont augmenté de 5,8 mg/dl (4,9 à 6,8) (22,4 %) vs 1,8 mg/dl (0,9 à 2,7) (6,9 %) (p < 0,001), les taux médians de triglycérides ont diminué de 24,8 mg/dl (- 35,4 à – 17,3) (20,5 %) vs 8,9 mg/dl (- 14,2 à – 1,8) (6,2 %) (p < 0,001). Les patients traités par rimonabant ont présenté de plus grandes diminutions des taux de protéine C-réactive ultrasensible (1,3 mg/dl [- 1,7 à – 1,2] [50,3 %] vs 0,9 mg/dl [- 1,4 à – 0,5] [30,9 %]) et une moindre augmentation des taux d'hémoglobine glyquée (0,11 % [0,02 % à 0,20 %] vs 0,40 % [0,31 % à 0,49 %]) (p < 0,001 pour les deux comparaisons). Les effets indésirables psychiatriques étaient plus fréquents dans le groupe rimonabant (43,4 % vs 28,4 %, p < 0,001).
Conclusions Après 18 mois de traitement, l'étude n'a pas démontré d’effet du rimonabant sur la progression de la maladie pour le critère primaire de jugement (PAV), mais a montré un effet favorable sur le critère secondaire (TAV). Afin de déterminer si le rimonabant est utile dans la prise en charge de la coronaropathie, il conviendra d’attendre les résultats d’autres études cliniques et en imagerie, qui sont actuellement en cours.
L’obésité a atteint des proportions épidémiques dans de nombreux pays industrialisés, en particulier aux États-Unis où 66 % de la population adulte sont considérés en surpoids et 34 % sont obèses, avec un indice de masse corporelle supérieur à 30.1,2 Les épidémiologistes prévoient une évolution constante de l’épidémie d’obésité et de ses conséquences sur la santé publique au cours des prochaines décennies, qui affectera tant les pays industrialisés que ceux en développement.3,4 L’obésité abdominale induit des anomalies métaboliques majeures et est associée à un risque accru de maladie cardiovasculaire athéroscléreuse.5-11 Les conséquences métaboliques et physiologiques associées à l’obésité abdominale incluent une incidence majorée de diabète de type 2 ou d’intolérance au glucose, d’hypertension, de faibles taux de HDL (high-density lipoprotein)-cholestérol (HDL-C), et de taux majorés de triglycérides et de biomarqueurs d’inflammation systémique.9-11
Peu de stratégies de prise en charge de l'obésité ont démontré des effets à long terme. En conséquence, le développement de nouvelles approches pharmacologiques pour le traitement de l'obésité abdominale et de ses effets métaboliques présente un intérêt considérable. Une approche prometteuse est l’inhibition des récepteurs cannabinoïdes de type 1 (CB1) qui sont présents dans le système nerveux central et périphérique.12 L'inhibition des récepteurs CB1 entraîne une réduction de la prise alimentaire et une diminution du poids corporel, et produit des effets métaboliques incluant une augmentation des taux de HDL-C et une réduction des taux de triglycérides, de protéine C-réactive ultrasensible (hsCRP), et d'hémoglobine glyquée (HbA1c) chez les patients diabétiques.13-16
Le premier antagoniste des récepteurs CB1 mis sur le marché est le rimonabant, qui est disponible dans plusieurs pays mais n'a pas été encore approuvé par la Food and Drug Administration américaine (FDA). En juin 2007, une commission de la FDA a suspendu l'approbation du rimonabant en attendant la clarification de questions de sécurité, principalement des effets indésirables psychiatriques, dont l’anxiété et la dépression.17,18
La progression de l'athérosclérose est favorisée par divers facteurs de risques individuels, incluant des taux élevés de cholestérol total ou de LDL (low-density lipoprotein)-C et de triglycérides, de faibles taux de HDL-C, une pression artérielle systolique élevée, et le diabète.19-24 Dans la mesure où la diminution du poids corporel et du tour de taille est associée à des changements favorables du profil lipidique, de la sensibilité à l'insuline, et des taux de HsCRP,25,26 nous avons tenté de déterminer si l’administration du rimonabant, antagoniste des CB1, pouvait réduire la progression de l’athérosclérose coronaire chez des patients avec une obésité abdominale présentant un syndrome métabolique et une coronaropathie préexistante. L’étude STRADIVARIUS (Strategy to Reduce Atherosclerosis Development Involving Administration of Rimonabant – The Intravascular Ultrasound Study) a utilisé l’échographique endo-coronaire pour évaluer la progression de l'athérosclérose. Au cours des dernières années, cette technique d’imagerie a été communément utilisée dans l'évaluation en série de la charge de cette maladie.19
MÉTHODES
Schéma de l’étude
L'étude STRADIVARIUS était une étude prospective, multicentrique, internationale, randomisée, en double-aveugle, contrôlée contre placebo, en 2 groupes parallèles. Elle incluait 112 centres d’Amérique du Nord (États-Unis et Canada), d'Europe, et d’Australie. Les comités d’éthique de tous les centres participants ont approuvé le protocole, et tous les participants ont donné leur consentement éclairé écrit.
Les patients étaient éligibles seulement s'ils nécessitaient également une angiographie coronaire pour une indication clinique, le plus souvent une douleur thoracique ischémique ou un résultat anormal à un examen fonctionnel comme l'épreuve d’effort ou la scintigraphie. Les patients étaient éligibles s'ils étaient âgés de 18 ans ou plus, avaient un tour de taille supérieur à 88 cm pour les femmes ou 102 cm pour les hommes, et répondaient aux critères prédéfinis pour la présence du syndrome métabolique ou étaient des fumeurs actuels. Le syndrome métabolique était défini par 2 des facteurs de risque suivants ou plus : un taux de triglycérides supérieur à 150 mg/dl (pour convertir en mmol/l, multiplier par 0,0113) ; un taux de HDL-C inférieur à 40 mg/dl (hommes) ou 50 mg/dl (femmes) (pour convertir en mmol/l, multiplier par 0,0259) ; une glycémie à jeun supérieure à 110 mg/dl (pour convertir en mmol/l, multiplier par 0,0555) ; ou une hypertension artérielle de 140/90 mm Hg ou plus ou l’utilisation actuelle de médicaments antihypertenseurs. Le tabagisme actuel était défini par la consommation de plus de 10 cigarettes par jour. L'éligibilité du patient nécessitait que l'angiographie cliniquement indiquée révèle au moins 1 obstruction coronaire avec un rétrécissement supérieur à 20 % du diamètre luminal.
Les principaux critères d'exclusion incluaient une précédente chirurgie de l’obésité, un diabète non contrôlé (défini par un taux de HbA1c > 10 %), ou un examen des urines positif au tétrahydrocannabinol. L'administration concomitante d'autres médicaments anti-obésité tels que l'orlistat ou la sibutramine, à l’inclusion et pendant l'étude, était interdite. Pour évaluer l’innocuité du rimonabant dans une large population, l'étude a intentionnellement inclus les patients ayant un antécédent de troubles psychiatriques.
La race/ethnicité était évaluée par l'investigateur ou le coordonnateur de l'étude. Ces informations ont été recueillies pour déterminer si la réponse au traitement (efficacité et innocuité) différait entre les individus de différentes origines raciales ou ethniques.
Cathétérisme et échographie intra-vasculaire à l’inclusion
De précédentes publications ont décrit les méthodes d'échographie intra-vasculaire (IVUS).19-24,27,28 Une seule artère était choisie pour l'IVUS, généralement le gros tronc épicardique le plus long et le moins anguleux. Cette artère ne devait pas avoir subi de précédente revascularisation, ni présenter de rétrécissement luminal supérieur à 50 % sur toute la longueur d’un segment de 30 mm minimum. De la nitroglycérine a été administrée par voie intra-coronaire pour prévenir le vasospasme et pour normaliser la tonicité vasculaire. Un cathéter d'échographie (Atlantis ; Boston Scientific Scimed Inc., Maple Grove, Minnesota) a été introduit dans le vaisseau cible, et le transducteur d’imagerie placé en aval d’une artère latérale angiographiquement identifiable.
L'opérateur choisissait un point de départ pour l'examen IVUS, à la distance maximale pouvant être atteinte sans risque, afin de disposer du plus long segment possible pour l'analyse quantitative. Il activait ensuite un système motorisé qui entraînait le retrait du transducteur à une vitesse de 0,5 mm/s. Lors du retrait, les acquisitions étaient réalisées à une vitesse de 30 images/s et enregistrées sur cassette analogique. La qualité d’image a été revue dans un laboratoire central à la Cleveland Clinic, et seuls les patients répondant aux critères de qualité d’image pré-spécifiés étaient éligibles à l'étude.
Traitements et visites de suivi
Après avoir obtenu un examen IVUS initial satisfaisant, tous les patients ont été programmés pour une visite de randomisation dans les 2 semaines suivantes. Au cours de cette visite, ils ont été aléatoirement assignés à recevoir du rimonabant, 20 mg par jour, ou un placebo apparié, pendant 18 à 20 mois. Au moment de la randomisation, les patients ont été orientés vers un diététicien pour recevoir des conseils sur un régime modérément hypocalorique et, si nécessaire, il leur était recommandé d’arrêter de fumer. Les investigateurs ont été chargés d'instituer des modifications des facteurs de risque adaptées aux directives locales. Les patients sont revenus pour des visites de suivi programmées à l’inclusion, et 3, 6, 12, et 18 mois après la randomisation. Les évaluations biochimiques de routine ont été effectuées par des laboratoires locaux, et les mesures des biomarqueurs spécifiques par un laboratoire central (laboratoire de l'hôpital de Laval, ville de Québec, Québec, Canada).
Examen IVUS de suivi
Après une période de traitement de 18 à 20 mois, les patients participant activement ont subi un nouvel examen IVUS, qu’ils aient ou non poursuivi le médicament étudié (méthode en intention-de-traiter). Si un patient avait besoin d’une angiographie coronaire pour une indication clinique entre 12 et 18 mois après l’inclusion, l’examen IVUS de fin d’étude était effectué pour éviter de soumettre les patients à une procédure invasive supplémentaire à la visite finale à 18 mois. Pendant l'étude complémentaire, l'examen IVUS a été renouvelé en utilisant un système de retrait motorisé identique à celui utilisé dans l'étude initiale, commençant en aval de l’artère latérale distale choisie initialement. Cette procédure était destinée à obtenir une série d'images transversales à des sites identiques à l'examen initial.
Randomisation et dissimulation de l’assignation
Les patients et tout le personnel de l'étude étaient aveugles à l’assignation du traitement. La randomisation a été effectuée à l’aide d’un système de réponse vocale interactive qui utilisait un code de randomisation préétabli avec blocs de permutations aléatoires. L'étude prévoyait une attribution équilibrée du traitement (1:1), stratifiée par centre.
Analyses du laboratoire central
Les images étaient analysées dans un laboratoire central dédié aux évaluations des IVUS. Pour chaque séquence, un technicien commençait l'analyse au site de l’artère distale choisi initialement par l'investigateur, et continuait par l’analyse de chaque 60ème image de la séquence. La vitesse de retrait étant de 0,5 mm/s, cette procédure identifiait des coupes transversales espacées d’exactement 1,0 mm. Les mesures échographiques intravasculaires ont été effectuées selon les normes de l'American College of Cardiology et de la Société européenne de cardiologie.29 À l’aide d’un logiciel spécialisé (ImageJ, version 1.29w ; National Institutes of Health, Bethesda, Maryland), le technicien effectuait un calibrage en mesurant des repères matriciels de 1 mm dans l'image. Les contours des volumes de la lumière et de la membrane élastique externe (MEE) ont été tracés par planimétrie manuelle. De précédents rapports ont établi l'exactitude et la reproductibilité de cette méthode.30
Calcul des paramètres d’efficacité IVUS
Le critère primaire d'efficacité, le pourcentage du volume de l'athérome (PAV), a été calculé comme suit :
PAV = [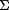 (MEECSA - LUMIERECSA/ (MEECSA - LUMIERECSA/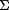 MEECSA] X 100, où MEECSA est la surface de la MEE en coupe et LUMIERECSA la surface luminale en coupe. MEECSA] X 100, où MEECSA est la surface de la MEE en coupe et LUMIERECSA la surface luminale en coupe.
Le critère secondaire d'efficacité, le volume total d'athérome (TAV) normalisé, a été calculé en déterminant d'abord la surface moyenne de l'athérome par coupe transversale, selon la formule suivante :
Surface moyenne de l'athérome = 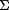 (MEECSA - LUMIERECSA) /n, où MEECSA est la surface de la MEE en coupe, LUMENCSA la surface luminale en coupe, et n le nombre de coupes transversales appariées analysables dans le retrait à l’inclusion et au suivi. (MEECSA - LUMIERECSA) /n, où MEECSA est la surface de la MEE en coupe, LUMENCSA la surface luminale en coupe, et n le nombre de coupes transversales appariées analysables dans le retrait à l’inclusion et au suivi.
Le TAV normalisé pour chaque patient a été calculé par la surface moyenne de l’athérome multipliée par le nombre médian de coupes transversales appariées dans les retraits pour tous les patients ayant achevé l'étude. Cette procédure inclut un ajustement sur les retraits avec des nombres différents de coupes transversales évaluées, produisant une pondération égale de chaque patient dans le calcul des résultats d'efficacité.
Le pourcentage du volume de l'athérome a été choisi comme critère primaire d'efficacité parce que ce critère a démontré la plus faible variabilité dans plusieurs études IVUS portant sur diverses interventions thérapeutiques.20-24
Analyses exploratoires de l'IVUS
Deux critères d’efficacité exploratoires additionnels de l’IVUS ont été évalués, la variation de l’épaisseur maximale moyenne de l’athérome et la variation du volume de l'athérome dans le sous-segment de 10 mm le plus gravement atteint. Bien qu’ils n’aient pas été pré-spécifiés, ces deux critères ont été utilisés dans de précédentes études IVUS et ont été évalués pour fournir un meilleur aperçu des effets du rimonabant sur l'athérosclérose coronaire.
Critères cliniques et mesures d’innocuité
Bien que l'étude n'ait pas été conçue pour évaluer des critères cliniques, les patients ont été suivis pour la survenue d’événements indésirables cardiovasculaires majeurs incluant l'infarctus du myocarde, l’accident vasculaire cérébral, le décès cardiovasculaire, et l'hospitalisation pour angor instable, revascularisation (chirurgicale ou par intervention percutanée), ou accident ischémique transitoire. Le protocole spécifiait l'inclusion des événements survenant avec la première administration du médicament de l'étude, les patients étant censurés à la date du dernier contact. D'autres événements indésirables ont été évalués à partir de la première dose du médicament étudié jusqu'à 75 jours après l'administration de la dernière dose. Tous les événements indésirables étaient rapportés par l’investigateur en utilisant le dictionnaire MedDRA (Medical Dictionary for Regulatory Activities).
Après le lancement de l'étude, les données évolutives d'autres études sur le rimonabant ont indiqué un risque d’événements indésirables neurologiques et psychiatriques. En conséquence, un questionnaire détaillé a été élaboré et ajouté à l'évaluation des patients effectuée par le personnel de chaque centre, pendant toutes les visites ultérieures liées à l’étude, afin de standardiser les rapports (amendement au protocole du 30 septembre 2005).
Méthodes statistiques
Le protocole de l'étude et le plan d'analyse statistique spécifiaient que l'analyse primaire d'efficacité devait inclure tous les patients randomisés avec un résultat d'examen IVUS évaluable tant à l’inclusion qu’après 12 mois ou plus de traitement, que le patient ait ou non effectivement reçu le médicament étudié ou se soit conformé au protocole de l'étude (méthode en intention-de-traiter modifiée incluant les patients avec des résultats IVUS d’inclusion et de suivi analysables). Le plan d'analyse statistique établissait la réalisation de tests de normalité pour les critères d'efficacité et d’une analyse non paramétrique si les données n'étaient pas normalement distribuées. Les analyses de l’innocuité incluaient tous les patients ayant reçu au moins 1 dose du médicament étudié.
Le critère primaire d'efficacité, la variation du PAV, a été analysé à l’aide d’un modèle de covariance, avec le traitement comme effet fixe et la valeur initiale en covariable. L'interaction entre la valeur initiale et le traitement a également été évaluée. Une analyse de sensibilité a été effectuée en utilisant une technique d’imputation multiple (PROC MI dans SAS) pour imputer des données IVUS pour les patients n’ayant pas effectué l’IVUS de suivi. Les variations des paramètres biologiques ont été analysées à l’aide d’un modèle mixte pour mesures répétées avec des termes pour la valeur initiale, le traitement, la visite, et l'interaction entre le traitement et la visite. Les moyennes des moindres carrés (intervalles de confiance [IC] à 95 %) sont rapportées.
Les calculs de puissance supposaient une différence de traitement de 1,3 % avec un écart-type commun de 4,9 %, sur la base des résultats d’une précédente étude IVUS comparant un abaissement intensif vs modéré des lipides.23 Ces hypothèses ont produit une puissance de 90 % pour une taille d'échantillon de 300 patients analysables par groupe de traitement. Les études invasives de régression/progression incluent généralement des patients en plus pour tenir compte de la non-réalisation des examens de suivi chez tous les patients. Sur la base des précédentes expériences, l'étude STRADIVARIUS supposait que 25 % des patients n'effectueraient pas l’IVUS final. En conséquence, le protocole spécifiait la randomisation de 800 patients (400 par groupe) pour tenir compte des abandons. Les analyses ont été effectuées à l’aide du logiciel SAS version 8.2 (SAS Institute, Cary, Caroline du Nord).
RÉSULTATS
Population de patients
Entre décembre 2004 et décembre 2005, 1 949 patients ont été sélectionnés dans 126 centres des États-Unis, du Canada, d'Europe, et d’Australie. L'organigramme des patients de l'étude est présenté dans la FIGURE 1, incluant les raisons des échecs de sélection et des abandons. Sur les patients sélectionnés, 839 répondaient à tous les critères d'inclusion, dont un IVUS initial acceptable, et ont reçu le médicament étudié dans 112 centres. Un total de 676 patients avait un examen IVUS analysable à l’inclusion et après le suivi minimum prédéfini de 320 jours.
|
|

|
Figure 1. Organigramme des patients dans l’étude
|
|
|
Les caractéristiques démographiques initiales et les traitements concomitants pour les 839 patients randomisés sont rapportés dans le TABLEAU 1. Il n'y avait aucune différence majeure dans les caractéristiques initiales des 676 patients avec IVUS analysable aux deux temps d’évaluation et des 163 patients n'ayant pas achevé l'évaluation IVUS (données non rapportées). En moyenne, les patients étaient âgés de moins de 60 ans ; environ deux-tiers étaient des hommes. Ils présentaient une obésité abdominale, avec un tour de taille moyen d’environ 117 cm et un indice de masse corporelle moyen de 35 (calculé par le poids en kilogrammes, divisé par le carré de la taille en mètres). Un pourcentage élevé de patients présentait des comorbidités liées à l’obésité spécifiées dans les critères d'inclusion, incluant l'hypertension et la dyslipidémie. Il n'y avait aucune différence significative dans les caractéristiques initiales des patients randomisés dans les 2 groupes de traitement.
|
|

|
Tableau 1. Caractéristiques initiales de la population étudiée (n = 839)a
|
|
|
Critères biologiques
Le TABLEAU 2 présente les valeurs biologiques, le poids corporel, le tour de taille, et la pression artérielle à l’inclusion et au suivi, pour les 676 patients ayant des examens IVUS d’inclusion et de suivi analysables, inclus dans l’analyse d’efficacité. Les patients randomisés au rimonabant ont perdu plus de poids et ont présenté une plus grande réduction du tour de taille que ceux traités par placebo. Comparé au placebo, il y avait également des différences significatives dans la réduction des taux de triglycérides et de hsCRP, dans l'élévation des taux de HDL-C, et dans la variation des taux de HbA1c et d'insuline. Cependant, les taux de LDL-C et la pression artérielle ne différaient pas significativement entre les groupes de traitement. Les variations au fil du temps du poids corporel, du tour de taille, des taux de HDL-C, de triglycérides, d’insuline, et de HbA1c sont présentées dans la FIGURE 2. Ces données montrent des différences significatives dans les taux de HDL-C, de triglycérides, de hsCRP, de HbA1c, et d'insuline dans le groupe traité par rimonabant, tant à 12 mois qu’à 18 mois post-randomisation.
|
|

|
Tableau 2. Poids corporel, tour de taille, critères métaboliques, et pression artérielle chez les patients ayant achevé l’étude (n = 676)a
|
|
|
|
|

|
Figure 2. Effets du rimonabant sur le poids corporel, le tour de taille et les taux de HDL (high-density lipoprotein)-cholestérol, de triglycérides, d’insuline à jeun et d’hémoglobine glycosylée (HbA1c)
Les repères et les barres d’erreur indiquent les moyennes des moindres carrés et les intervalles de confiance à 95 % respectivement, pour le poids corporel, le tour de taille, le HDL-C et le HbA1C, ainsi que les médianes et les extrêmes interquartiles pour les triglycérides et l’insuline à jeun. Facteurs de conversion IS : pour convertir les valeurs de HDL-C en mmol/L, multiplier par 0,0259 ; les triglycérides en mmol/L, multiplier par 0,0113.
|
|
|
Analyses d'efficacité par IVUS
Le TABLEAU 3 rapporte les résultats des analyses de l'IVUS montrant les valeurs initiales, les valeurs de suivi, et les variations en cours d’étude par rapport à l’inclusion. La variation dans la moyenne des moindres carrés (IC 95 %) du critère primaire d'efficacité, le PAV, était de 0,51 % (0,22 % à 0,80 %) dans le groupe placebo et de 0,25 % (- 0,04 % à 0,54 %) dans le groupe rimonabant (p = 0,22). La variation dans la moyenne des moindres carrés (IC 95 %) du critère secondaire d’efficacité pré-spécifié, le TAV normalisé, était de 0,88 mm3 (- 1,03 à 2,79) dans le groupe placebo et de - 2,2 mm3 (- 4,09 à – 0,24) dans le groupe rimonabant (p = 0,03). Le changement de – 2,2 mm3 par rapport à l’inclusion dans le TAV du groupe rimonabant était statistiquement significatif (p = 0,03).
|
|

|
Tableau 3. Inclusion, suivi et variation par rapport à l’inclusion des critères d’échographie intravasculaire chez les patients ayant achevé l’étude (n = 676)
|
|
|
Sous-groupes
La FIGURE 3 rapporte les résultats pour le critère primaire d’efficacité dans les différents sous-groupes. Bien que la plupart des catégories n'aient pas présenté d’hétérogénéité, 2 sous-groupes présentaient des interactions statistiquement significatives. Pour les patients ne prenant pas de statine à l’inclusion, la variation du PAV était supérieure dans le groupe placebo comparé au groupe rimonabant (différence moyenne des moindres carrés [IC 95 %], - 1,31 [- 2,29 à – 0,33]), tandis que les patients sous statine présentaient des résultats similaires dans les deux groupes de traitement (différence moyenne des moindres carrés [IC 95 %], - 0,06 [- 0,51 à 0,39]) (p = 0,03 pour l'interaction des sous-groupes).
|
|

|
Figure 3. Critère primaire d’efficacité (pourcentage du volume de l’athérome) dans les sous-groupes
Les valeurs de p indiquées concernent l’interaction des sous-groupes. Les valeurs entre parenthèses dans la colonne « caractéristiques initiales » indiquent la valeur médiane pour chaque caractéristique. IC indique l’intervalle de confiance ; CRP, protéine C-réactive ; HDL, high-density lipoprotein ; LDL, low-density lipoprotein ; MC, moindres carrés ; PAV, pourcentage du volume de l’athérome.
|
|
|
Une interaction était également observée pour les patients dichotomisés par taux initiaux de triglycérides. Pour les patients présentant des taux de triglycérides médians ( 140,0 mg/dl), la moyenne des moindres carrés (IC 95 %) de la différence entre traitements était de - 0,77 (- 1,35 à – 0,18) en faveur du rimonabant, tandis que les patients avec une triglycéridémie initiale inférieure à la médiane ne présentaient aucune différence entre traitements (0,16 % [- 0,40 à 0,72]) (p = 0,03 pour l'interaction des sous-groupes). 140,0 mg/dl), la moyenne des moindres carrés (IC 95 %) de la différence entre traitements était de - 0,77 (- 1,35 à – 0,18) en faveur du rimonabant, tandis que les patients avec une triglycéridémie initiale inférieure à la médiane ne présentaient aucune différence entre traitements (0,16 % [- 0,40 à 0,72]) (p = 0,03 pour l'interaction des sous-groupes).
Analyses exploratoires IVUS
Dans la mesure où les critères primaire et secondaire présentaient des résultats divergents, des analyses exploratoires ont été effectuées sur des critères d’efficacité additionnels utilisés dans de précédentes études d'IVUS. La moyenne des moindres carrés (IC 95 %) de l'épaisseur maximale moyenne de l’athérome a augmenté de 0,01 mm (0,006 à 0,020) dans le groupe placebo et a diminué de 0,0006 mm (- 0,008 à 0,007) dans le groupe rimonabant (p = 0,01). Le volume de l’athérome dans le sous-segment de 10 mm le plus gravement atteint a diminué de 0,89 mm3 (- 1,791 à 0,018) pour le groupe placebo et de 1,47 mm3 (- 2,36 à - 0,59) pour le groupe rimonabant (p = 0,37).
Résultats d’IVUS avec imputation pour les abandons
Pour déterminer l’influence potentielle des patients randomisés n’ayant pas terminé l’évaluation IVUS, nous avons effectué une analyse de sensibilité post hoc, dans laquelle des valeurs ont été imputées pour les abandons, sur la base des caractéristiques initiales des patients. La technique d'imputation attribuait des variations dans les critères d'efficacité pour chaque abandon en se basant sur les caractéristiques initiales du patient, incluant les données démographiques, les valeurs biologiques, et le volume initial de l'athérome. Pour le critère primaire d'efficacité, le PAV, le groupe placebo présentait une augmentation moyenne (IC 95 %) de 0,57 % (0,29 % à 0,84 %), vs 0,25 % (- 0,04 % à 0,55 %) pour le groupe rimonabant (p = 0,13). Pour le critère secondaire d’efficacité pré-spécifié, le TAV, le groupe placebo présentait une augmentation moyenne (IC 95 %) de 1,19 mm3 (- 0,73 à 3,12) vs – 1,95 mm3 (- 3,8 à – 0,10) pour le groupe rimonabant (p = 0,02).
Critères cardiovasculaires et mortalité
Le TABLEAU 4 rapporte l'incidence des événements indésirables cardiovasculaires majeurs, les événements indésirables les plus fréquents induits par le traitement, et les motifs les plus fréquents d’arrêts du médicament étudié liés aux événements indésirables. Le critère composite de décès cardiovasculaire, infarctus du myocarde non fatal, accident vasculaire cérébral non fatal, ou hospitalisation pour angor instable, revascularisation, ou accident ischémique transitoire, a été observé chez 46 patients sous placebo (11 %) et 44 patients sous rimonabant (10,4 %) (p = 0,79). Les composantes individuelles de ce critère ne présentaient aucun profil constant suggérant des différences entre le placebo et le rimonabant. Huit décès (2 cardiovasculaires et 6 non cardiovasculaires) sont survenus chez les patients sous placebo, et 2 (non cardiovasculaires) chez les patients sous rimonabant (p = 0,06) (TABLEAU 4).
|
|

|
Tableau 4. Événements indésirables cardiovasculaires majeurs, événements indésirables liés au traitement, et motifs d’arrêt du médicament étudié (population randomisée, n = 839)
|
|
|
Événements indésirables
Les événements indésirables induits par le traitement les plus fréquents incluaient des troubles psychiatriques, survenus chez 118 patients sous placebo (28,4 %) et 183 patients sous rimonabant (43,4 %) (p < 0,001). Ces événements indésirables consistaient principalement en une majoration de l’anxiété et de la dépression. Les effets indésirables psychiatriques graves, définis par la dépression majeure, les idées suicidaires, la tentative de suicide ou le suicide réalisé, sont survenus avec une fréquence similaire chez les patients sous placebo et sous rimonabant (3,8 % vs 4,7 %, respectivement ; p = 0,52). Un seul patient du groupe placebo a fait une tentative de suicide, et un seul patient du groupe rimonabant a réussi son suicide. Les troubles digestifs étaient également déséquilibrés entre les 2 groupes ; ils ont été observés chez 74 patients sous placebo (17,8 %) et chez 142 patients traités par rimonabant (33,6 %) (p < 0,001). Les événements indésirables étaient plus susceptibles d’induire l’arrêt du traitement chez les patients sous rimonabant que chez ceux sous placebo (74 [17,5 %] vs 31 [7,5 %], p < 0,001). Les taux cumulés d’arrêt du traitement sont présentés dans la FIGURE 4.
|
|

|
Figure 4. Incidence cumulée d’arrêt de traitement
IC indique l’intervalle de confiance ; RRI, rapport des risques instantanés.
|
|
|
COMMENTAIRE
L'obésité abdominale, même en l'absence de diabète de type 2, est associée à une constellation d'anomalies métaboliques et physiologiques qui majorent le risque de maladie cardiovasculaire athéroscléreuse.11 Les facteurs de risque les plus significatifs liés à l'obésité abdominale incluent l'hypertension, les faibles taux de HDL-C, les taux majorés de triglycérides et de hsCRP, et l’intolérance au glucose. Au cours des dernières années, cet ensemble de facteurs de risques a été regroupé sous le terme de syndrome métabolique ; il est désormais défini dans les recommandations comme une cible secondaire dans la prise en charge des patients à haut risque cardiovasculaire.31,32
Bien que des agents pharmacologiques spécifiques soient efficaces dans le traitement des composantes individuelles du syndrome métabolique, il existe peu d'options traitant directement la physiopathologie sous-jacente de ce trouble, en particulier l’obésité abdominale. Une approche prometteuse est basée sur les effets centraux et périphériques produits par l’inhibition des récepteurs CB1. Le premier agent de ce type mis sur le marché, le rimonabant, a démontré une efficacité dans la réduction du poids corporel et de l'obésité abdominale, parallèlement à une amélioration de plusieurs composantes du syndrome métabolique.13-16
Nous avons tenté de déterminer si le rimonabant ralentirait la progression de la maladie coronarienne chez les patients présentant une obésité abdominale avec une coronaropathie préexistante. L'administration de rimonabant (20 mg par jour) pendant 18 mois n'a pas significativement réduit le taux de progression de maladie coronarienne pour le critère primaire de l'IVUS, la variation du PAV. Cependant, le critère secondaire, la variation du TAV, a démontré un effet statistiquement significatif en faveur du rimonabant. Compte tenu de la divergence des effets du rimonabant observée pour les critères primaire et secondaire, nous avons effectué des analyses exploratoires post hoc additionnelles en utilisant d'autres critères d'efficacité communément utilisés dans des études d'IVUS. La variation dans l'épaisseur maximale moyenne de l’athérome a été favorablement influencée par le rimonabant. Cependant, la variation du volume de l'athérome dans le sous-segment de 10 mm le plus atteint ne démontrait aucune différence significative entre les traitements.
En conséquence, bien que l'étude n'ait pas atteint de significativité pour le critère primaire, elle a néanmoins démontré des effets favorables pour d'autres critères IVUS. Ces observations suggèrent que les antagonistes des CB1 pourraient être efficaces dans la réduction de la progression de la maladie coronarienne, mais nécessiteront de nouvelles études pour confirmer un effet anti-athéroscléreux.
Il n'y a aucune explication évidente pour la divergence observée dans les critères IVUS primaire et secondaire, bien que le PAV se soit révélé le critère le plus fiable dans de précédentes études examinant la réduction du LDL-C avec des statines. Cependant, les effets du rimonabant n'incluent pas l'abaissement du LDL-C, mais plutôt des réductions du poids corporel et du tour de taille, une augmentation des taux de HDL-C, et une réduction des taux d’insuline et de hsCRP. Les réponses vasculaires aux traitements anti-athéroscléreux sont complexes et impliquent des variations dans les volumes de l'athérome et de la MEE. Le PAV représente le rapport du volume de l'athérome au volume de la MEE, tandis que le TAV n’est qu’une mesure de la variation du volume de l'athérome. En théorie, le mécanisme d'action du rimonabant induit des effets sur le volume de l'athérome et de la MEE différents de ceux observés précédemment avec le traitement par statines. D’autres études sont nécessaires pour déterminer si les traitements qui augmentent les taux de HDL-C agissent différemment sur les composantes des parois artérielles que ceux qui réduisent les taux de LDL-C.
Bien que le rimonabant ait été approuvé dans plusieurs pays, un comité consultatif de la FDA a refusé son approbation et a demandé des données de sécurité complémentaires sur ses effets indésirables psychiatriques.17 Dans la présente étude, afin de mieux caractériser la sécurité du rimonabant dans une large population, nous avons délibérément inclus des patients avec et sans antécédent de maladie psychiatrique. En outre, nous avons modifié le protocole pour inclure un questionnaire destiné à standardiser la notification de ces effets indésirables. Nos résultats confirment que l'inhibition des récepteurs CB1 par le rimonabant majore les effets indésirables gastro-intestinaux et psychiatriques, en particulier l’anxiété, la dépression, et les nausées. L'inclusion de patients avec une histoire de maladie psychiatrique et l'utilisation d'un questionnaire ont produit un taux supérieur de troubles psychiatriques rapportés dans les groupes placebo et rimonabant comparés aux études antérieures. Bien que ces effets indésirables aient induit une majoration des arrêts de traitement, 73 % des patients ont pu mener à terme les 18 mois de traitement par rimonabant, comparés à 84 % dans le groupe placebo.
Les effets indésirables psychiatriques graves, incluant la dépression majeure, les idées suicidaires, les tentatives de suicide ou les suicides réalisés étaient relativement rares, survenant à une fréquence similaire chez les patients sous placebo et sous rimonabant (respectivement 3,8 % vs 4,7 % ; p = 0,52). Cependant, la puissance de l'étude ne permettait pas d’évaluer les effets psychiatriques graves. Un patient sous placebo a effectué une tentative de suicide, et un patient sous rimonabant a réussi son suicide. Dans l’interprétation de ces données, il convient de noter que la réduction de l’obésité et du poids corporel était liée à une incidence majorée de la dépression.33 Dans l’ensemble, nos résultats démontrent que le rimonabant est associé à une augmentation des symptômes psychiatriques.
Les effets du rimonabant sur le poids corporel, le tour de taille, et les taux sériques de lipides, de hsCRP, et de HbA1c observés dans l'étude STRADIVARIUS étaient de même amplitude que ceux de précédentes études sur cette substance.13-16 Ces effets incluaient une réduction de 4,3 kg du poids corporel, une réduction de 4,5 cm du tour de taille, une augmentation 22,4 % des taux de HDL-C, et une réduction de 20,5 % des taux de triglycérides (TABLEAU 2 et FIGURE 2). Ces changements se sont maintenus tout au long des 18 mois de l'étude (FIGURE 2).
Une question importante consiste à savoir pourquoi ces changements n'ont pas entraîné de réduction plus conséquente du taux de progression de l'athérosclérose coronaire. Une explication potentielle réside dans les taux élevés d'administration d'autres traitements bénéfiques dans la population étudiée. Plus de 80 % des patients recevaient des statines à l’inclusion et pendant l'étude, avec des taux moyens de LDL-C sous traitement d'environ 87 mg/dl. Les précédentes études d'IVUS ont démontré que les taux de LDL-C sont un facteur prédictif très fort des taux de progression.21,23,24 Il a été difficile de démontrer un bénéfice différentiel en présence d’un traitement médical optimal, en particulier chez les patients avec des taux de LDL-C bien-contrôlés.27,28 La durée relativement courte du traitement peut également constituer un facteur limitant l'ampleur du bénéfice. Il reste également possible que les effets biologiques du rimonabant soient insuffisants pour produire un bénéfice anti-athéroscléreux.
Dans la présente étude, nous avons effectué des analyses dans divers sous-groupes (FIGURE 3), qui n'avaient pas été pré-spécifiées. Ce type d’analyse est toujours considéré comme exploratoire et générateur d’hypothèse, mais peut produire des données sur les populations avec un bénéfice plus ou moins apparent. Deux de ces sous-groupes présentaient une hétérogénéité statistiquement significative - patients sous statines comparés à ceux sans statines et patients avec une triglycéridémie supérieure ou inférieure à la médiane. Le bénéfice plus substantiel observé chez les patients ne prenant pas de statines suggère que le traitement par rimonabant et statine peut avoir produit une superposition de bénéfices. Les résultats plus favorables dans le sous-groupe avec des taux élevés de triglycérides suggèrent que les patients présentant les plus fortes anomalies métaboliques pourraient tirer les plus grands bénéfices du traitement par antagonistes des CB1. L’éclaircissement de ces hypothèses nécessitera d’autres analyses post hoc, incluant une analyse multivariée des facteurs influençant les résultats.
Dans la mesure où la présente étude n'a pas obtenu d’effet statistiquement significatif pour le critère primaire d’efficacité, des études complémentaires seront requises pour mieux définir le rôle du rimonabant dans le traitement des patients avec obésité abdominale, coronaropathie et facteurs de risques métaboliques. Deux études randomisées contrôlées contre placebo sont actuellement en cours, l’étude AUDITOR (Atherosclerosis Underlying Development Assessed by Intima-Media Thickness in Patients on Rimonabant) (clinicaltrials.gov NCT00228176) et l'étude CRESCENDO (Comprehensive Rimonabant Evaluation Study of Cardiovascular Endpoints and Outcomes) (clinicaltrials.gov NCT00263042). L'étude AUDITOR est une étude de 24 mois sur les effets du rimonabant sur l'épaisseur intima-média carotidienne, et CRESCENDO est une étude sur les effets cardiovasculaires à long terme chez 17 000 patients à haut risque d’événements cardiovasculaires.
La présente étude présente plusieurs limites importantes. Elle incluait une population restreinte, spécifiquement des patients présentant au moins 1 sténose coronaire identifiée par angiographie. Cette population peut ne pas être représentative de la population plus large avec coronaropathie. L'échographie intra-vasculaire vise à mesurer la progression de la maladie, et il existe des données limitées concernant la capacité de cette mesure à prévoir l’évolution clinique. Les études de morbi-mortalité sont toujours l'approche privilégiée pour déterminer les bénéfices cliniques de toute intervention. Dans les études d’imagerie invasive, certains patients n'effectuent pas les examens IVUS de l’inclusion et du suivi. L'absence de données d’imagerie pour les abandons peut potentiellement introduire des biais dans les analyses. En conséquence, nous avons effectué une analyse de sensibilité post hoc dans laquelle des valeurs ont été imputées pour les abandons, sur la base des caractéristiques initiales. Bien que toutes les valeurs de p pour les critères d'efficacité IVUS aient légèrement varié avec les données imputées, l'interprétation globale de l'étude n'a pas été affectée. Enfin, la durée d'exposition au rimonabant était relativement courte (18 mois), ce qui peut avoir été insuffisant pour observer un effet du traitement sur le taux de progression de l'athérosclérose coronaire.
En dépit de ces limites, nous pensons que l'étude STRADIVARIUS soutient les conclusions suivantes. Le traitement par rimonabant, antagoniste des CB1, pendant 18 mois, a réduit le poids corporel et le tour de taille et amélioré les profils lipidiques, les mesures glycémiques, et les taux de hsCRP, mais n'a pas significativement réduit l'athérosclérose pour le critère d’efficacité primaire, qui était la variation du PAV. Cependant, le traitement par rimonabant a démontré un effet favorable statistiquement significatif pour un critère secondaire d'IVUS et un critère exploratoire additionnel. En conséquence, cet agent pourrait avoir un effet favorable sur la progression de l'athérosclérose. Des effets indésirables gastro-intestinaux et psychiatrique significatifs ont été observés, mais généralement d’intensité légère ou modérée. Nous pensons que cette approche du traitement de l'obésité abdominale, par inhibition des récepteurs CB1 avec le rimonabant, reste prometteuse dans le traitement des patients avec coronaropathie, et qu’elle devrait être explorée dans de nouvelles études cliniques.
Informations sur les auteurs
Correspondance: Steven E. Nissen, MD, Department of Cardiovascular Medicine, Cleveland Clinic Foundation, 9500 Euclid Ave, Cleveland, OH 44195 (nissens{at}ccf.org).
Publié en ligne: 1 avril 2008 (doi:10.1001/jama.299.13.1547).
Affiliations des auteurs : Department of Cardiovascular Medicine and Cleveland Clinic Lerner School of Medicine (Drs Nissen, Nicholls, Kapadia, Bhatt, Lincoff, Tuzcu et Ms Wolski) and Department of Quantitative Health Sciences, Cleveland Clinic (Dr Hu), Cleveland, Ohio; Laval Hospital and Quebec Heart Institute, Quebec City, Canada (Drs Rodés- Cabau et Després); TIMI Study Group, Cardiovascular Division, Brigham and Women’s Hospital and Harvard Medical School, Boston, Massachusetts (Dr Cannon); University College, London, England (Dr Deanfield); Academic Medical Center, Amsterdam, the Netherlands (Dr Kastelein); University of Kentucky, Lexington (Dr Steinhubl); Southwest Cardiology, Oklahoma City, Oklahoma (Dr Yasin); Instytut Kardiologii I Klinika Warsaw, Warsaw, Poland (Dr Ruzyllo); Sanofi-Aventis, Paris, France (Drs Gaudin et Job).
Contributions des auteurs : Le Dr. Nissen a eu plein accès à toutes les données de l'étude et accepte la responsabilité de l'intégrité des données et de l'exactitude de l'analyse de données.
Conception et schéma de l’étude : Nissen, Cannon, Deanfield, Despres, Kapadia, Gaudin, Job, Tuzcu.
Recueil des données : Nissen, Nicholls, Rodes-Cabau, Despres, Yasin, Ruzyllo, Tuzcu.
Analyse et interprétation des données : Nissen, Nicholls, Wolski, Cannon, Deanfield, Despres, Kastelein, Steinhubl, Kapadia, Gaudin, Job, Hu, Bhatt, Lincoff, Tuzcu.
Rédaction du manuscrit: Nissen, Deanfield, Tuzcu.
Revue critique du manuscrit: Nissen, Nicholls, Wolski, Rodes-Cabau, Cannon, Deanfield, Despres, Kastelein, Steinhubl, Kapadia, Yasin, Ruzyllo, Gaudin, Job, Hu, Bhatt, Lincoff, Tuzcu.
Analyse statistique: Nissen, Wolski, Cannon, Hu.
Obtention du financement: Nissen, Gaudin.
Aide administrative, technique ou matérielle: Nissen, Nicholls, Cannon, Deanfield, Despres, Gaudin, Bhatt, Lincoff, Tuzcu.
Supervision de l’étude: Nissen, Rodes-Cabau, Cannon, Deanfield, Despres, Kastelein, Kapadia, Yasin, Gaudin, Job.
Liens financiers : Le Dr. Nissen a déclaré avoir reçu un soutien pour ses recherches d'AstraZeneca, Atherogenics, Eli Lilly, Novartis, Pfizer, Takeda, Daiichi-Sankyo, et Sanofi-Aventis et avoir été consultant pour un certain nombre d'entreprises pharmaceutiques sans compensation financière (tous les honoraires, honoraires de consultation, ou tous les autres paiements pour des organisations commerciales ont été payés directement à des fonds de charité, de sorte que ni le revenu ni un abattement fiscal ne soit perçu). Le Dr. Nicholls a déclaré avoir reçu des honoraires de Pfizer, d'AstraZeneca, de Takeda, et de Schering-Plough, de Merck ; des honoraires de consultation d'AstraZeneca, de Pfizer, de Roche, de Novo-Nordisk, de Liposcience, et d'Anthera Pharmaceuticals; et un soutien pour ses recherches d'AstraZeneca et de Lipid Sciences. Le Dr. Rodés-Cabau a déclaré recevoir un soutien pour ses recherches de Sanofi-Aventis, Boston scientific, St Jude Medical, et d’Actelion et des honoraires de conférence ou de consultant d'AstraZeneca, de Medtronic, et d'Edwards Lifesciences. Le Dr. Cannon a déclaré avoir reçu un soutien sous la forme d’une bourse de recherches d'Accumetrics, d'AstraZeneca, de Bristol-Meyers Squibb, de GlaxoSmithKline, de Merck, de Sanofi-Aventis, et de Schering Plough. Le Dr. Deanfield a rapporté avoir reçu une bourse de d'Aspreva pharmaceuticals, de Pfizer, et de Merck et des honoraires de conférencier ou de consultation d'AstraZeneca, de Merck, de Novartis, de Pfizer, de Roche, Sanofi-Aventis, et de Takeda. Le Dr. Després a rapporté avoir reçu des honoraires en tant que conseiller ou conférencier d'AstraZeneca, Eli Lilly, GlaxoSmithKline, Innodia, Merck, Novartis, Pfizer Inc, Pharmacia Corp, Sanofi-Aventis, et Solvay et des bourses de recherches d'Eli Lilly, de GlaxoSmithKline, d'Innodia, et de Sanofi-Aventis. Le Dr. Kastelein a déclaré avoir reçu des bourses de recherches de Schering-Plough, de Merck, Pfizer, Sanofi-Aventis, d’'AstraZeneca, de Roche Pharmaceuticals, d'ISIS, et d’Aspreva Pharma et des honoraires de conférencier ou de consultant de Schering-Plough, de Merck, de Pfizer, Sanofi-Aventis, d’AstraZeneca, de Roche, d'ISIS Pharmaceuticals, de Lipid Science, de Lexicon Pharmaceuticals, de Kinemed, et Novartis. Le Dr. Steinhubl a déclaré avoir reçu des honoraires pour les comités consultatifs de Sanofi-Aventis, Bristol-Myers Squibb, Daiichi Sankyo, d'Eli Lilly, d'AstraZeneca, de Portola, et de Medicines Company et un soutien pour ses recherches d'Eli Lilly, de Medicines Company, et de Regado ; commençant le 1er février 2008, le Dr. Steinhubl devenu salarié de Medicines Company. Le Dr. Bhatt a déclaré avoir reçu des courses de recherches (directement à l'établissement) de Bristol Myers Squibb, Eisai, Ethicon, Heartscape, Sanofi-Aventis (pour des esssais y compris CRESCENDO sur le rimonabant, auquel il sert d'investigateur principal international), et Medicines Company ; des honoraires (donnés à des organisations non commerciales >2 ans) d'AstraZeneca, de Bristol-Myers Squibb, de Centocor, de Daiichi- Sankyo, d'Eisai, d'Eli Lilly, de GlaxoSmithKline, Millénium, Paringenix, PDL, Sanofi-Aventis, Schering Plough, de Medicines Company, et tns Healthcare; d’avoir siégé au bureau des conférenciers (> 2 ans) de Bristol-Myers Squibb, de Sanofi-Aventis, et de Medicines Company; d’avoir servi de conseiller au comité consultatif d'Astellas, d'AstraZeneca, de Bristol-Myers Squibb, de Cardax, de Centocor, de Cogentus, de Daiichi- Sankyo, d'Eisai, d'Eli Lilly, de GlaxoSmithKline, de Johnson & Johnson, de McNeil, de Medtronic, de Millenium, de Molecular Insights, d'Otsuka, de Paringenix, de PDL, de Philips, de Portola, de Sanofi-Aventis, de Schering-Plough, de Scios, de tns Healthcare, et de Vertex; et d’avoir apporté une témoignage d’expert concernant le clopidogrel (>2 ans ; compensation donnée à une organisation non commerciale). Le centre de coordination clinique de Cleveland reçoit actuellement ou a reçu un financement de recherches d'Abraxis, Alexion Pharma, AstraZeneca, Atherogenics, Aventis, Biosense Webster, Biosite, Boehringer Ingelheim, Boston scientifique, Bristol-Myers Squibb, Cardionet, Centocor, Convergent Medical inc., CORDIS, Dr. Reddy's, Edwards Lifesciences, Esperion, GE médical, Genentech, Gilford, GlaxoSmithKline, Guidant, Johnson & Johnson, Kensey-Nash, Lilly, Medtronic, Merck, Mytogen, Novartis, Novo Nordisk, Orphan Therapeutics, P & G Pharma, Pfizer, Roche, Sankyo, Sanofi-Aventis, Schering-Plough, Scios, St Jude Medical, Takeda, TMC, VasoGenix, et Viacor. Le Dr. Lincoff a déclaré avoir été consultant pour un certain nombre d'entreprises pharmaceutiques mais a demandé qu’elles donnent tous les honoraires ou les honoraires de consultation directement à des fonds de charité de sorte qu'il ne reçoive ni le revenu ni l'abattement fiscal. Le Dr. Tuzcu a déclaré avoir reçu des honoraires de consultation de Pfizer et des honoraires de Pfizer et de Merck. Aucune autre déclaration n'a été faite.
Financement/Soutien: Cette étude a été soutenue par Sanofi-Aventis.
Rôle du sponsor: Sanofi-Aventis a participé aux discussions concernant la conception et le développement du protocole de l’étude et a apporté un soutien logistique pendant l'essai. La surveillance de l'étude a été exécutée par le commanditaire, qui a également maintenu la base de données de l’essai. Les critères de l’échographie intra-vasculaire ont été mesurés par le centre de coordination cardio-vasculaire de la clinique de Cleveland. Des analyses statistiques ont été exécutées indépendamment par le commanditaire et le centre de coordination, avec des résultats contre-vérifiés pour l'exactitude entre les 2 équipes statistiques. Le manuscrit a été préparé par l'auteur correspondant et modifié après consultation avec les autres auteurs. Le commanditaire a été autorisé à revoir le manuscrit pour suggérer des changements, mais la décision finale sur le contenu a été exclusivement maintenue par les auteurs universitaires.
Analyse statistique indépendante: Une analyse statistique indépendante a été conduite par Kathy Wolski, MPH, du département de médecine cardio-vasculaire de la fondation clinique de Cleveland. Mme Wolski a reçu la base de données de l’essai du commanditaire, qui a inclus toutes les données brutes, pas simplement les ensembles dérivés des données, et a indépendamment calculé les paramètres intra-vasculaires échographiques d'efficacité, les mesures de tolérance, les paramètres biologiques, et les variables démographiques. Mme Wolski est employée par le centre de coordination cardio-vasculaire de la clinique de Cleveland, qui a reçu une compensation du commanditaire de l'épreuve, y compris le paiement des services statistiques. Une analyse statistique indépendante additionnelle a été exécutée par Bo Hu, PhD, du département des sciences quantitatives de santé à la clinique de Cleveland. Le Dr. Hu est également affilié au Department of Statistics at Case Western Reserve University. Le Dr. HU a reçu la base de données de l’essai complète et a indépendamment confirmé les résultats de Mme Wolski. Le Dr. Hu a reçu une compensation du centre de coordination, mais pas du commanditaire, pour ses services statistiques. Les résultats rapportés dans cet article sont basés sur les analyses indépendantes.
Investigateurs STRADIVARIUS: comité directeur: Steven Nissen (Chair), Cleveland Clinic, Cleveland, Ohio; Christopher Cannon, Brigham & Women’s Hospital, Boston, Massachusetts; John Deanfield, University College, London, England; Jean-Pierre Després, Laval Hospital Research Center, Quebec City, Quebec, Canada; Christophe Gaudin (nonvoting) and Bernard Job (nonvoting), sanofi-aventis, Paris, France; John Kastelein, Academic Medical Center, Amsterdam, the Netherlands; Josep Rodès-Cabau, Laval Hospital, Quebec City, Quebec, Canada; Steven Steinhubl, MD, University of Kentucky, Lexington. Bureau de surveillance des données et de la tolérance: Robert Frye (Chair), Mayo Clinic, Rochester, Minnesota; Robert Harrington and Kerry Lee, Duke University, Durham, North Carolina; Marc Buyse, International Drug Development Institute, Belgium. Investigateurs (*indique les sites qui étaient actifs, mais où aucun dépistage des patients n’a été réalisé au cours de l’étude): Australie: New South Wales: John Hunter Hospital, New Lambton (G. Bellamy, MD); Royal Prince Alfred Hospital, Camperdown (M. Adams, PR); Queensland: Core Research Group, Milton (D. Colquhoun, PR); Victoria: Monash Medical Centre Cardiovascular Research, Clayton ( J. Cameron, PR). Belgique: Cliniques Universitaires Saint Luc Service de Pharmacie, Bruxelles ( J. Renkin, PR); Ziekenhuis Oost-Limburg Dienst Apotheek, Genk (M. Vrolix, MD); UZ Antwerpen Dienst Apotheek, Edegem (C. Vrints, PR); OLV Ziekenhuis Dienst Apotheek, Aalst (B. De Bruyne, MD); Hôpital de Charleroi Service, Charleroi ( J. Lalmand, MD)*. Canada: Quebec: Hopital Laval Cardiologie, Sainte-Foy (J. Rodes-Cabau, MD); Hopital Maisonneuve- Rosemont Recherche Clinique Polyclinique, Montreal (C. Constance, MD); Montreal Heart Institute Research Center, Montreal (R. Gallo, MD); Alberta: Foothills Medical Centre, Calgary (M. Curtis, MD); Ontario: Toronto General Hospital University Health Network, Toronto (L. Schwartz, MD); British Columbia: Victoria Heart Institute Foundation, Victoria (W.P. Klinke, MD). France: Hôpital Rangueil, Toulouse ( J. Puel, PR); Hôpital Europeen G. Pompidou, Paris (A. Lafont, PR)*; Chu Henri Mondor, Creteil (E. Teiger, PR); Hôpital Claude Galien Service Angiographie, Quincy Sous Senart (P. Garot, MD); Hôpital Louis Pradel Pharmacie, Bron (G. Finet, PR)*; Hôpital Marie Lannelongue, Le Plessis Robinson (C. Caussin, MD); Hopital Haut-Lévêque, Pessac (P. Coste, PR, MD). Italie: Ospedale San Raffaele Unità Di Emodinamica E Cardiologia Interventistica, Milano (A. Colombo, MD); Ospedale S. Maria Della Misericordia Strutt, Udine (G. Bernardi, MD); Centro Cardiologico Monzino, Milan (A. Bartorelli, MD); Ospedale Cisanello, Pisa (A. Petronio, PR); Ospedale S. Giovanni Addolorata, Roma (F. Prati, MD); Policlinico San Matteo, Pavia (G. De Ferrari, MD); Isitituto Clinico Humanitas, Rozzano (P. Presbitero, MD). Pays-Bas: Olvg, Amsterdam (J.P.R. Herrman, MD, PhD); Catharina Ziekenhuis, Eindhoven ( J.J. Koolen, MD, PhD); Medisch Spectrum Twente, Enschede (C. Von Birgelen, PR, MD, PhD); Umc St Radboud, Nijmegen (W.R.M. Aengevaeren, MD, PhD); Amphia Ziekenhuis, Breda (P. Den Heijer, MD, PhD); Isala Klinieken, Zwolle (A.T.M. Gosselink, MD, PhD); St Antonius Ziekenhuis, Nieuwegein (B.J.W.M. Rensing, MD). Pologne: Instytut Kardiologii I Klinika Warszawa, Anin (W. Ruzyllo, PR, MD, PhD); Gornoslaskie Centrum Medyczne Sam Oddzial Ostrych Zespolow Wiencowych, Katowice (Pawel Buszman, MD, PhD); Gornoslaskie Centrum Medyczne Sam Iii Klinika Kardiologii, Katowice (A. Ochala, MD, PhD). Espagne: Hospital De Bellvitge Hemodinamica Feixa, Llarga (A. Cequier, MD); Hospital Cl nico San Carlos, Madrid (C. Macaya, MD); Hospital Del Mar Hemodinamica, Barcelona (A. Serra, MD); Hospital San Juan De Alicante Hemodinamica, San Juan ( J.Miguel Ruiz, MD); Hospital Gregorio Maran on Hemodinamica, Madrid ( J. Soriano, MD); Hospital Cl nico San Carlos, Madrid (C. Macaya, MD); Hospital Del Mar Hemodinamica, Barcelona (A. Serra, MD); Hospital San Juan De Alicante Hemodinamica, San Juan ( J.Miguel Ruiz, MD); Hospital Gregorio Maran on Hemodinamica, Madrid ( J. Soriano, MD); Hospital Cl nico De Malaga Hemodinamica, Malaga ( J.M. Hernandez, MD); Hospital Central De Asturias Hemodinamica, Oviedo (I. Lozano, MD); Hospital Vall DHebron Hemodinamica, Barcelona ( J. Angel, MD). Etats-Unis : Alabama: The Heart Group, Mobile (C. Alford, MD); California: Northern California Medical Associates, Santa Rosa (P. Coleman, MD); VA Medical Center Division of Cardiology, Los Angeles (R. Ebrahimi, MD); St Josephs Medical Center, Stockton (D. Primack, MD)*; Radiant Research, Santa Rosa (S. Dhar, MD); Los Angeles Cardiology Associates, Los Angeles (R. Matthews, MD); Kaiser Permanente, San Francisco (M. Tawadrous, MD); Golden Gate Cardiology, San Francisco (G. Milechman, MD); Sacramento Heart and Vascular Research, Sacramento (D. Roberts, MD); VA San Diego Healthcare System, San Diego (W. Penny, MD); University of California San Diego (E. Mahmud, MD); Colorado: University of Colorado Health Sciences Center, Denver ( J. C. Messenger, MD); Florida: Orlando Heart Center, Orlando (R. Dalton, MD); Florida Cardiovascular Research at JFK Medical Center, Atlantis (M. Rothenberg, MD); The Heart and Vascular Institute of Florida, Safety Harbor (M. Krolick, DO); Cardiology Consultants, Pensacola (W. Pickens, MD); St Vincents Medical Center, Jacksonville (G. Pilcher, MD); Clearwater Cardiovascular & International Consultants, Clearwater ( J.T. Zelenka, MD); Sarasota Memorial Health Care System Clinical Research Center, Sarasota (S. Culp, MD); Miami International Cardiology Consultants, Miami Beach ( J.Margolis, MD); Florida Cardiovascular Institute, Tampa (F. Matar, MD); Mima Century Research Associates, Melbourne (R. Vicari, MD); University of Florida Health Science Center, Jacksonville (M. Costa, MD); Pasco Cardiology, Hudson (P. Rossi, MD); Heart Center, Port Charlotte (V. Howard, MD); Illinois: Heart Care Research Foundation, Blue Island (R. Iaffaldano, MD); Indiana: Cardiovascular Clinics, Merrillville (T. Nguyen, MD); Midwest Medical Group, Elkhart (D. Westerhausen, MD); Iowa: Iowa Heart Center, Des Moines (M. Ghali, MD); Kansas: Cardiovascular Research Shawnee Mission Medical Center, Shawnee Mission (P. Kramer, MD); Kentucky: Cardiology Associates Research, Edgewood (M. Jordan, MD);University of Louisville University Cardiology Research, Louisville (M. Leesar, MD); Gill Heart Institute University of Kentucky, Lexington (K. Ziada, MD); Louisiana: TCA Research, Covington (G. Lasala, MD); Maryland: HPV Heart, Columbia (W. Herzog, MD); Peninsula Cardiology Associates, Salisbury ( J. Raffetto, MD); John Hopkins University, Baltimore ( J. Resar, MD); Washington Adventist Hospital, Takoma Park (M. Turco, MD); Sinai Hospital, Baltimore (P. Gurbel, MD); Michigan: Michigan Heart, Ypsilanti ( J. Wilks, MD); Cardiac and Vascular Research Center of Northern Michigan, Petoskey (L. Cannon, MD); Covenant Medical Center Cardiovascular Research, Saginaw (W. Felten, MD); Borgess Research Institute Borgess Medical Center, Kalamazoo (A.J. Carter, MD); University of Michigan Health Systems, Ann Arbor (S.J. Chetcuti, MD); Cardiology Research, Road Royal Oak (G. Hanzel, MD); Michigan Cardiovascular Institute, Saginaw (R. Gudipati, MD); Minnesota: 225 North Smith Avenue Suite 400, St Paul (K. Baran, MD); Central Minnesota Heart Center, St Cloud (B. Erickson, MD). Mississippi: Memphis Heart Clinic, Southaven (S. Himmelstein, MD); Missouri: Kansas City Heart Foundation, Kansas City (E. Hockstad, MD); Nebraska: Nebraska Heart Institute, Lincoln (P. Dionisopoulos, MD); New Mexico: New Mexico Heart Institute, Albuquerque (J. Batty, MD); New York: Buffalo Cardiology & Pulmonary Associates, Williamsville ( J. Corbelli, MD); Capital Cardiology, Troy (A. Delago, MD); Metropolitan Cardiology Consultants, LLC, Pomono (C. Hirsch, MD); Strong Memorial Hospital University of Rochester Medical Center, Rochester (F. Ling, MD); Buffalo Heart Group, Buffalo (A. R. Zaki Masud, MD); South Bay Cardiovascular, Islip (D. Reich, MD);NYU Medical Center, New York (M. Attubato, MD); Hudson Valley Heart Center Vassar Brothers Medical Center, Poughkeepsie (M. Zubair Jafar, MD); North Carolina: Wake Forest University Health Sciences Department of Cardiology Medical Center, Winston-Salem (T. Baki, MD)*; East Carolina University School of Medicine Division of Cardiology, Greenville ( J. Babb, MD); Lebauer Cardiovascular Research Foundation, Greensboro (B. Brodie, MD); Ohio: Davies Heart and Lung Research Institute, Columbus (R. Magorien, MD)*; University Hospitals of Cleveland, Cleveland (R. Nair, MD); Cardiovascular Medicine Associates, Middleburg Heights (M. Schrode, DO); Medical College of Ohio, Toledo (W. Colyer, MD); Cleveland Clinic, Cleveland (R. Raymond, DO); Oklahoma: Oklahoma Heart Institute, Tulsa (W. Leimbach, MD); Southwest Cardiology, Oklahoma City (M. Yasin, MD); Oregon: Oregon Cardiology, Eugene (S. Cook, MD); Hillsboro Cardiology, Hillsboro (S. Promisloff, MD); Pennsylvania: The Heart Group, Lancaster (P. Casale, MD); University of PA Medical Center-Presbyterian Division of Cardiology, Philadelphia (R.H. Li, MD); Moffitt Heart & Vascular Group, Wormleysburg (W. Bachinsky, MD); University of Pittsburgh Medical Center, Pittsburgh (O. Marroquin, MD); Penn State Milton S. Hershey Medical Center, Hershey (I. Gilchrist, MD); Geisinger Clinic, Danville ( J. Blankenship, MD); South Carolina: Upstate Cardiology, Greenville ( J. Cebe, MD); Tennessee: VA Memphis, Memphis (K.B. Ramanathan, MD); Parkway Cardiology Associates, Oak Ridge (M. Sharma, MD); Texas: University of Texas Health Science Center at San Antonio (D. Patel, MD); Virginia: Sentara Norfolk General Hospital, Norfolk (P. Mahoney, MD); University of Virginia Health System Hospital, Charlottesville (M. Ragosta, MD); Inova Research Center, Falls Church (B. Raybuck, MD)*; Washington: The Hope Heart Institute, Bellevue (T. Amidon, MD); Wisconsin: Milwaukee Cardiovascular Research Foundation, Milwaukee (A. Arnold, DO). Coordinateurs nationaux : Australie: James Cameron, MD; Belgique: Jean Renkin, MD; Canada: Josep Rodes, MD; France: Jacques Puel, MD; Italie: Antonio Colombo, MD; Pologne: Witold Ruzyllo, MD, PhD; Espagne: Angel R. Cequier, MD; Pays-Bas: Gert-Jan Laarman, MD; Etats-Unis: Ian Gilchrist, MD; Stanley Chetcuti, MD. Personnel du laboratoire central d’échographie intra-vasculaire: Tim Crowe, William Magyar, Jordan Andrews, Tammy Churchill, Anne Colagiovanni, Jessica Fox, Teresa Fonk, Karilane King, Aaron Loyd, Erin Mayock, Kara McInturff, Rhiannon Regal, Andrea Winkhart and Jay Zhitnik. nico De Malaga Hemodinamica, Malaga ( J.M. Hernandez, MD); Hospital Central De Asturias Hemodinamica, Oviedo (I. Lozano, MD); Hospital Vall DHebron Hemodinamica, Barcelona ( J. Angel, MD). Etats-Unis : Alabama: The Heart Group, Mobile (C. Alford, MD); California: Northern California Medical Associates, Santa Rosa (P. Coleman, MD); VA Medical Center Division of Cardiology, Los Angeles (R. Ebrahimi, MD); St Josephs Medical Center, Stockton (D. Primack, MD)*; Radiant Research, Santa Rosa (S. Dhar, MD); Los Angeles Cardiology Associates, Los Angeles (R. Matthews, MD); Kaiser Permanente, San Francisco (M. Tawadrous, MD); Golden Gate Cardiology, San Francisco (G. Milechman, MD); Sacramento Heart and Vascular Research, Sacramento (D. Roberts, MD); VA San Diego Healthcare System, San Diego (W. Penny, MD); University of California San Diego (E. Mahmud, MD); Colorado: University of Colorado Health Sciences Center, Denver ( J. C. Messenger, MD); Florida: Orlando Heart Center, Orlando (R. Dalton, MD); Florida Cardiovascular Research at JFK Medical Center, Atlantis (M. Rothenberg, MD); The Heart and Vascular Institute of Florida, Safety Harbor (M. Krolick, DO); Cardiology Consultants, Pensacola (W. Pickens, MD); St Vincents Medical Center, Jacksonville (G. Pilcher, MD); Clearwater Cardiovascular & International Consultants, Clearwater ( J.T. Zelenka, MD); Sarasota Memorial Health Care System Clinical Research Center, Sarasota (S. Culp, MD); Miami International Cardiology Consultants, Miami Beach ( J.Margolis, MD); Florida Cardiovascular Institute, Tampa (F. Matar, MD); Mima Century Research Associates, Melbourne (R. Vicari, MD); University of Florida Health Science Center, Jacksonville (M. Costa, MD); Pasco Cardiology, Hudson (P. Rossi, MD); Heart Center, Port Charlotte (V. Howard, MD); Illinois: Heart Care Research Foundation, Blue Island (R. Iaffaldano, MD); Indiana: Cardiovascular Clinics, Merrillville (T. Nguyen, MD); Midwest Medical Group, Elkhart (D. Westerhausen, MD); Iowa: Iowa Heart Center, Des Moines (M. Ghali, MD); Kansas: Cardiovascular Research Shawnee Mission Medical Center, Shawnee Mission (P. Kramer, MD); Kentucky: Cardiology Associates Research, Edgewood (M. Jordan, MD);University of Louisville University Cardiology Research, Louisville (M. Leesar, MD); Gill Heart Institute University of Kentucky, Lexington (K. Ziada, MD); Louisiana: TCA Research, Covington (G. Lasala, MD); Maryland: HPV Heart, Columbia (W. Herzog, MD); Peninsula Cardiology Associates, Salisbury ( J. Raffetto, MD); John Hopkins University, Baltimore ( J. Resar, MD); Washington Adventist Hospital, Takoma Park (M. Turco, MD); Sinai Hospital, Baltimore (P. Gurbel, MD); Michigan: Michigan Heart, Ypsilanti ( J. Wilks, MD); Cardiac and Vascular Research Center of Northern Michigan, Petoskey (L. Cannon, MD); Covenant Medical Center Cardiovascular Research, Saginaw (W. Felten, MD); Borgess Research Institute Borgess Medical Center, Kalamazoo (A.J. Carter, MD); University of Michigan Health Systems, Ann Arbor (S.J. Chetcuti, MD); Cardiology Research, Road Royal Oak (G. Hanzel, MD); Michigan Cardiovascular Institute, Saginaw (R. Gudipati, MD); Minnesota: 225 North Smith Avenue Suite 400, St Paul (K. Baran, MD); Central Minnesota Heart Center, St Cloud (B. Erickson, MD). Mississippi: Memphis Heart Clinic, Southaven (S. Himmelstein, MD); Missouri: Kansas City Heart Foundation, Kansas City (E. Hockstad, MD); Nebraska: Nebraska Heart Institute, Lincoln (P. Dionisopoulos, MD); New Mexico: New Mexico Heart Institute, Albuquerque (J. Batty, MD); New York: Buffalo Cardiology & Pulmonary Associates, Williamsville ( J. Corbelli, MD); Capital Cardiology, Troy (A. Delago, MD); Metropolitan Cardiology Consultants, LLC, Pomono (C. Hirsch, MD); Strong Memorial Hospital University of Rochester Medical Center, Rochester (F. Ling, MD); Buffalo Heart Group, Buffalo (A. R. Zaki Masud, MD); South Bay Cardiovascular, Islip (D. Reich, MD);NYU Medical Center, New York (M. Attubato, MD); Hudson Valley Heart Center Vassar Brothers Medical Center, Poughkeepsie (M. Zubair Jafar, MD); North Carolina: Wake Forest University Health Sciences Department of Cardiology Medical Center, Winston-Salem (T. Baki, MD)*; East Carolina University School of Medicine Division of Cardiology, Greenville ( J. Babb, MD); Lebauer Cardiovascular Research Foundation, Greensboro (B. Brodie, MD); Ohio: Davies Heart and Lung Research Institute, Columbus (R. Magorien, MD)*; University Hospitals of Cleveland, Cleveland (R. Nair, MD); Cardiovascular Medicine Associates, Middleburg Heights (M. Schrode, DO); Medical College of Ohio, Toledo (W. Colyer, MD); Cleveland Clinic, Cleveland (R. Raymond, DO); Oklahoma: Oklahoma Heart Institute, Tulsa (W. Leimbach, MD); Southwest Cardiology, Oklahoma City (M. Yasin, MD); Oregon: Oregon Cardiology, Eugene (S. Cook, MD); Hillsboro Cardiology, Hillsboro (S. Promisloff, MD); Pennsylvania: The Heart Group, Lancaster (P. Casale, MD); University of PA Medical Center-Presbyterian Division of Cardiology, Philadelphia (R.H. Li, MD); Moffitt Heart & Vascular Group, Wormleysburg (W. Bachinsky, MD); University of Pittsburgh Medical Center, Pittsburgh (O. Marroquin, MD); Penn State Milton S. Hershey Medical Center, Hershey (I. Gilchrist, MD); Geisinger Clinic, Danville ( J. Blankenship, MD); South Carolina: Upstate Cardiology, Greenville ( J. Cebe, MD); Tennessee: VA Memphis, Memphis (K.B. Ramanathan, MD); Parkway Cardiology Associates, Oak Ridge (M. Sharma, MD); Texas: University of Texas Health Science Center at San Antonio (D. Patel, MD); Virginia: Sentara Norfolk General Hospital, Norfolk (P. Mahoney, MD); University of Virginia Health System Hospital, Charlottesville (M. Ragosta, MD); Inova Research Center, Falls Church (B. Raybuck, MD)*; Washington: The Hope Heart Institute, Bellevue (T. Amidon, MD); Wisconsin: Milwaukee Cardiovascular Research Foundation, Milwaukee (A. Arnold, DO). Coordinateurs nationaux : Australie: James Cameron, MD; Belgique: Jean Renkin, MD; Canada: Josep Rodes, MD; France: Jacques Puel, MD; Italie: Antonio Colombo, MD; Pologne: Witold Ruzyllo, MD, PhD; Espagne: Angel R. Cequier, MD; Pays-Bas: Gert-Jan Laarman, MD; Etats-Unis: Ian Gilchrist, MD; Stanley Chetcuti, MD. Personnel du laboratoire central d’échographie intra-vasculaire: Tim Crowe, William Magyar, Jordan Andrews, Tammy Churchill, Anne Colagiovanni, Jessica Fox, Teresa Fonk, Karilane King, Aaron Loyd, Erin Mayock, Kara McInturff, Rhiannon Regal, Andrea Winkhart and Jay Zhitnik.
Présentation antérieure: Présenté en partie à l’American College of Cardiology; 1er avril 2008 ; 57ème Annual Scientific Session, Chicago, Illinois.
Autres contributions: Nous remercions Marilyn Borgman, RN (chef de projet), Craig Balog, BS, et Amy Hsu, MS (soutien statistique). Ces personnes sont employées par le centre de coordination cardio-vasculaire de la clinique de Cleveland et n'étaient pas compensée pour leur participation à l'étude.
Voir l’éditorial p 1601.
BIBLIOGRAPHIE
 |  |
1. New CDC study finds no increase in obesity among adults; but levels still high. Centers for Disease Control and Prevention National Center for Health Statistics Web site. http://www.cdc.gov/nchs/pressroom/07newsreleases/obesity.htm. Accessibility verified March 3, 2008.
2. Ogden CL, Carroll MD, Curtin LR, McDowell MA, Tabak CJ, Flegal KM. Prevalence of overweight and obesity in the United States, 1999-2004. JAMA. 2006;295(13):1549-1555.
FREE FULL TEXT
3. Yach D, Stuckler D, Brownell KD. Epidemiologic and economic consequences of the global epidemics of obesity and diabetes [published correction appears in Nat Med. 2006;12(3):367]. Nat Med. 2006;12(1):62-66.
PUBMED
4. Allison DB, Fontaine KR, Manson JE, Stevens J, VanItallie TB. Annual deaths attributable to obesity in the United States. JAMA. 1999;282(16):1530-1538.
FREE FULL TEXT
5. Yusuf S, Hawken S, Ounpuu S, et al. INTERHEART Study Investigators. Obesity and the risk of myocardial infarction in 27,000 participants from 52 countries: a case-control study. Lancet. 2005;366(9497):1640-1649.
PUBMED
6. Hubert HB, Fenileib M, McNamara PM, et al. Obesity as an independent risk factor for cardiovascular disease: a 26-year follow-up of participants in the Framingham Heart Study. Circulation. 1983;67(5):968-977.
FREE FULL TEXT
7. Kim KS, Owen WL, Williams D, et al. A comparison between BMI and Conicity index on predicting coronary heart disease: the Framingham Heart Study. Ann Epidemiol. 2000;10(7):424-431.
PUBMED
8. Rimm EB, Stampfer MJ, Giovannucci E, et al. Body size and fat distribution as predictors of coronary heart disease among middle-aged and older US men. Am J Epidemiol. 1995;141(12):1117-1127.
FREE FULL TEXT
9. Klein S, Burke LE, Bray GA, et al. American Heart Association Council on Nutrition, Physical Activity, and Metabolism. Clinical implications of obesity with specific focus on cardiovascular disease: a statement for professionals from the American Heart Association Council on Nutrition, Physical Activity, and Metabolism: endorsed by the American College of Cardiology Foundation [published online ahead of print October 27, 2004]. Circulation. 2004;110(18):2952-2967. doi:10.1161/01.CIR.0000145546.97738.1E.
FREE FULL TEXT
10. Balkau B, Deanfield JE. Despre s JP, et al. International Day for the Evaluation of Abdominal Obesity (IDEA): a study of waist circumference, cardiovascular disease, and diabetes mellitus in 168,000 primary care patients in 63 countries. Circulation. 2007; 116(17):1942-1951.
FREE FULL TEXT
11. Despre s JP, Lemieux I. Abdominal obesity and metabolic syndrome. Nature. 2006;444(7121):881-887.
PUBMED
12. Cota D.. CB1 receptors: emerging evidence for central and peripheral mechanisms that regulate energy balance, metabolism, and cardiovascular health. Diabetes Metab Res Rev. 2007;23(7):507-517.
PUBMED
13. Scheen AJ, Finer N, Hollander P, Jensen MD, Van Gaal LF.; RIO-Diabetes Study Group. Efficacy and tolerability of rimonabant in overweight or obese patients with type 2 diabetes: a randomised controlled study [published correction appears in Lancet. 2006;368(9548):1650]. Lancet. 2006;368(9548):1660-1672.
PUBMED
14. Pi-Sunyer FX, Aronne LJ, Heshmati HM, Devin J, Rosenstock J.; RIO-North America Study Group. Effect of rimonabant, a cannabinoid-1 receptor blocker, on weight and cardiometabolic risk factors in overweight or obese patients: RIO-North America: a randomized controlled trial [published correction appears in JAMA. 2006;295(11):1252]. JAMA. 2006;295(7):761-775.
FREE FULL TEXT
15. Despre s JP, Golay A, Sjö ström L; Rimonabant in Obesity–Lipids Study Group. Effects of rimonabant on metabolic risk factors in overweight patients with dyslipidemia. N Engl J Med. 2005;353(20):2121-2134.
PUBMED
16. Van Gaal LF, Rissanen AM, Scheen AJ, Ziegler O. Rö ssner S; RIO-Europe Study Group. Effects of the cannabinoid-1 receptor blocker rimonabant on weight reduction and cardiovascular risk factors in overweight patients: 1-year experience from the RIOEurope study [published correction appears in Lancet. 2005;366(9483):370]. Lancet. 2005;365(9468):1389-1397.
PUBMED
17. Christensen R, Kristensen PK, Bartels EM, Bliddal H, Astrup A. Efficacy and safety of the weight-loss drug rimonabant: a meta-analysis of randomised trials. Lancet. 2007;370(9600):1706-1713.
PUBMED
18. Saul S.. FDA panel rejects drug for obesity. New York Times. June 14, 2007. http://www.nytimes.com/2007/06/14/business/14drugs.html?_r=1&fta=y&oref=slogin. Accessibility verified March 2, 2008.19. Nicholls SJ, Sipahi I, Schoenhagen P, Crowe T, Tuzcu EM, Nissen SE. Application of intravascular ultrasound in anti-atherosclerotic drug development [published online ahead of print May 12, 2006]. Nat Rev Drug Discov. 2006;5(6):485-492. doi:10.1038/nrd2040.
PUBMED
20. Nissen SE, Tsunoda T, Tuzcu EM, et al. Effect of recombinant ApoA-I Milano on coronary atherosclerosis in patients with acute coronary syndromes: a randomized controlled trial. JAMA. 2003;290(17):2292-2300.
FREE FULL TEXT
21. Nissen SE, Tuzcu EM, Brown BG, et al. Effect of intensive compared with moderate lipid-lowering therapy on progression of coronary atherosclerosis: a randomized controlled trial. JAMA. 2004;291(9):1071-1080.
FREE FULL TEXT
22. Nissen SE, Tuzcu EM, Libby P, et al. CAMELOT Investigators. Effect of antihypertensive agents on cardiovascular events in patients with coronary disease and normal blood pressure: the CAMELOT study: a randomized controlled trial. JAMA. 2004;292(18):2217-2225.
FREE FULL TEXT
23. Nissen SE, Tuzcu EM, Schoenhagen P, et al. Reversal of Atherosclerosis with Aggressive Lipid Lowering (REVERSAL) Investigators. Statin therapy, LDL cholesterol, C-reactive protein, and coronary artery disease. N Engl J Med. 2005;352(1):29-38.
PUBMED
24. Nissen SE, Nicholls SJ, Sipahi I, et al. ASTEROID Investigators. Effect of very high-intensity statin therapy on regression of coronary atherosclerosis: the ASTEROID trial [published online ahead of print March 13, 2006]. JAMA. 2006;295(13):1556-1565. doi:10.1001/jama.295.13.jpc60002.
FREE FULL TEXT
25. Eriksson KF. Lindga rde F. No excess 12-year mortality in men with impaired glucose tolerance who participated in the Malmö Preventive Trial with diet and exercise. Diabetologia. 1998;41(9):1010-1016.
PUBMED
26. Wadden TA, Anderson DA, Foster GD. Twoyear changes in lipids and lipoproteins associated with the maintenance of a 5% to 10% reduction in initial weight: some findings and some questions. Obes Res. 1999;7(2):170-178.
PUBMED
27. Nissen SE, Tuzcu EM, Brewer HB, et al. ACAT Intravascular Atherosclerosis Treatment Evaluation (ACTIVATE) Investigators. Effect of ACAT inhibition on the progression of coronary atherosclerosis [published correction appears in N Engl J Med. 2006;355(6):638]. N Engl J Med. 2006;354(12):1253-1263.
PUBMED
28. Nissen SE, Tardif JC, Nicholls SJ, et al. ILLUSTRATE Investigators. Effect of torcetrapib on the progression of coronary atherosclerosis [published online ahead of print March 26, 2007] [published correction appears in N Engl J Med. 2007;357(8):835]. N Engl J Med. 2007;356(13):1304-1316. doi:10.1056/NEJMoa070635.
PUBMED
29. Mintz GS, Nissen SE, Anderson WD, et al. American College of Cardiology Clinical Expert Consensus Document on Standards for Acquisition, Measurement and Reporting of Intravascular Ultrasound Studies (IVUS): a report of the American College of Cardiology Task Force on Clinical Expert Consensus Documents. J Am Coll Cardiol. 2001;37(5):1478-1492.
FREE FULL TEXT
30. Schoenhagen P, Sapp SK, Tuzcu EM, et al. Variability of area measurements obtained with different intravascular ultrasound catheter systems: impact on clinical trials and a method for accurate calibration. J Am Soc Echocardiogr. 2003;16(3):277-284.
PUBMED
31. Grundy SM, Cleeman JI, Merz CN, et al. Coordinating Committee of the National Cholesterol Education Program. Implications of recent clinical trials for the National Cholesterol Education Program Adult Treatment Panel III Guidelines. J AmColl Cardiol. 2004; 44(3):720-732.
32. Grundy SM.; National Cholesterol Education Program (NCEP)–The National Cholesterol Guidelines in 2001, Adult Treatment Panel (ATP) III. Approach to lipoprotein management in 2001 National Cholesterol Guidelines. Am J Cardiol. 2002;90(8A):11i-21i.
PUBMED
33. Onyike CU, Crum RM, Lee HB, Lyketsos CG, Eaton WW. Is obesity associated with major depression? results from the Third National Health and Nutrition Examination Survey. Am J Epidemiol. 2003;158(12):1139-1147.
FREE FULL TEXT
ARTICLES EN RAPPORT
Cette semaine dans le JAMA français
JAMA. 2008;299:1509.
Texte Complet
Les espoirs et les craintes du rimonabant
John S. Rumsfeld et Brahmajee K. Nallamothu
JAMA. 2008;299:1601.
Texte Complet
|