 |
 |

Pages du praticien
Efficacité des soins palliatifs spécialisésUne revue systématique
Camilla Zimmermann, MD, MSc;
Rachel Riechelmann, MD;
Monika Krzyzanowska, MD, MPH;
Gary Rodin, MD;
Ian Tannock, MD, PhD
JAMA. 2008;299(14):1698-1709
RÉSUMÉ
 |  |
Contexte Les équipes de soins palliatifs spécialisés fournissent de plus en plus de soin pour des patients ayant une affection terminale. Cependant, l'impact de ces équipes sur la qualité de vie, la satisfaction vis-à-vis des soins, et le coût économique n'a pas été examiné systématiquement à l’aide de critères détaillés pour étudiant la qualité.
Objectif Revue systématique des preuves d'efficacité des soins palliatifs spécialisés.
Sources des données Nous avons effectué une recherche par mot-clé des bases de données suivantes de leur commencement à janvier 2008 : MEDLINE, Ovid Healthstar, CINAHL, EMBASE, et le registre central de Cochrane des épreuves contrôlées.
Sélection des études Nous avons inclus toutes les essais contrôlés et randomisés dans lesquels les soins palliatifs spécialisés étaient l'intervention et pour lesquels les résultats incluaient la qualité de vie, la satisfaction avec les soins, ou le coût économique.
Extraction des données Les données sur la population, l'intervention, les résultats, les méthodes, et la qualité méthodologique ont été extraites par 2 investigateurs employant des critères normalisés.
Résultats Des 396 rapports d’essais contrôlés et randomisés, 22 répondaient à nos critères d'inclusion. Il y avait des preuves consistantes d'efficacité des soins palliatifs spécialisés dans l'amélioration de la satisfaction des familles concernant les soins (7 études sur 10 favorisaient l'intervention). Seulement 4 études sur 13 évaluant la qualité de vie et 1 sur 14 évaluant les symptômes montraient un avantage significatif de l'intervention ; cependant, la plupart des études manquaient de puissance statistique pour rapporter des résultats concluants, et les mesures de la qualité de vie n'étaient pas spécifiques pour les patients ayant une maladie terminale. Il y avait des preuves d’économies significatives avec des soins palliatifs spécialisés dans seulement 1 étude sur 7 ayant évalué ces résultats. Des limites méthodologiques ont été mises en évidence dans toutes les études, y compris la contamination du groupe témoin, l’insuffisance d'explication du regroupement dans les études de groupes randomisées, et des problèmes substantiels concernant le recrutement, les abandons et l’observance.
Conclusions Les preuves en faveur des soins palliatifs spécialisés sont rares et limitées par des points méthodologiques faibles. Des études soigneusement planifiées, utilisant une intervention palliative normalisée et des mesures de soin spécifiquement destinées à cette population, sont nécessaires.
La souffrance des patients présentant des maladies terminales est de plus en plus prise en compte, notamment, la douleur, les autres symptômes physiques, et la détresse psychosociale, qui peuvent apparaître de nombreux mois avant le décès. 1-3 Les services palliatifs spécialisés se sont développés à travers le monde, se concentrant initialement sur les soins des cancers terminaux, 4 mais élargissant de plus en plus leur champ d’action pour inclure des patients présentant un cancer ou d'autres maladies terminales à des stades plus précoces de leur maladie. 5 L'objectif de ces services est d'améliorer le contrôle des symptômes et la qualité de vie des patients présentant des maladies terminales et de coordonner les soins du patient et le soutien de la famille. 6 Avec le développement croissant de ces services, il est important de déterminer leur efficacité comparée à d'autres modèles de soins.
Des revues antérieures ont été réalisées sur l'efficacité des services de soins palliatifs, 6-12 mais seulement 2 d'entre elles, toutes deux publiées approximativement il y a une décennie, ont utilisé des critères détaillés de qualité pour évaluer la validité des études contrôlées et randomisées (RCT).7,12 Jusqu’à récemment, il n’y avait pas assez de RCT concernant les soins palliatifs spécialisés pour évaluer les études avec cette méthode, et quelques revues précédentes ont inclus à la fois des études rétrospectives et prospectives. 8-10 Il est plus difficile de réaliser des revues systématiques sur des interventions par des services de soins que de faire des revues d’interventions pharmacologiques, en raison d'une plus grande hétérogénéité des interventions et des méthodes.13 En préparant cette revue systématique, nous avons suivi les directives décrites par Grimshaw et coll., 14 basées sur les normes du Cochrane Effective Practice and Organization of Care Group.15 L'objectif de notre revue était d'examiner systématiquement les preuves d'efficacité des soins palliatifs spécialisés pour améliorer la qualité de vie, la satisfaction concernant les soins, et le coût économique.
METHODES
Stratégie des recherches
Les études ont été récupérées à partir de bases de données de leur début à janvier 2008 : MEDLINE, Ovid Healthstar, CINAHL, EMBASE, et le registre central de Cochrane des essais contrôlés. Le groupe de mots-clés utilisés était palliatif, terminal, ou hospice et qualité de vie, qualité de soin, satisfaction, bien-être, économique, ou coût ; la recherche a été limitée aux RCT. Nous avons également recherché manuellement les références des articles récupérés pour trouver d'autres études appropriées.
Critères de sélection
Nous avons choisi des rapports de RCT évaluant l'intervention d'un service de soin palliatif spécialisé, avec au moins 1 des résultats suivants, qualité de vie, satisfaction concernant les soins, ou coût économique. Un service de soin palliatif spécialisé était défini comme un service de professionnels fournissant ou coordonnant des soins approfondis pour des patients présentant une maladie terminale. Les études évaluant l'impact seulement d’un composant de soin palliatif approfondi sur un seul aspect de la qualité de vie (par exemple, impact des antalgiques sur la douleur ; impact du médicament ou d’une psychothérapie sur la dépression) étaient exclues.
Evaluation des études
Deux relecteurs (C.Z. et R.R.) extrayaient indépendamment les données à partir des études sélectionnées en utilisant un formulaire normalisé d'abstraction de données, basé sur le formulaire développé par le Effective Practice and Organization of Care Group.16 Toutes les différences d'opinion étaient résolues par discussion. L'information était extraite sur le contexte; la population d'étude ; type d'intervention et de contrôle ; critères de jugement et les résultats ; les méthodes ; les résultats ; et la qualité de l’étude. Certaines études pour lesquelles existaient de multiples publications étaient évaluées une seule fois, utilisant toutes les informations disponibles des publications respectives.
La validité des publications choisies était déterminée à l’aide de 25 critères de qualité, groupés en 7 catégories (ENCADRÉ). Celles-ci ont été développées après une revue complète des critères existants et basées sur 2 listes de contrôle employées pour évaluer la qualité du rapport des RCT, 17,18 une liste de contrôle employée pour évaluer la qualité des études utilisant des interventions pour améliorer la pratique professionnelle et la prestation des services de santé, 16 et 2 listes de contrôle conçues pour évaluer la qualité des études évaluant l'efficacité des soins palliatifs.7,12 Trois articles ont été modifiés, ajoutés, ou les deux, de sorte qu'ils puissent s'appliquer aux RCT réalisés sur des groupes.22-24 Ces articles incluaient la prise en compte des groupes dans le calcul de la taille de l’échantillon, 19,23,25 comprenant un nombre adéquat de groupes, 19,20,23 et prenant en compte le groupe dans l'analyse.19,24,26 Des points séparés étaient assignés pour la qualité des méthodes employées et pour la qualité de leur rapport.27 Les critères ont été pilotés sur 5 publications aléatoirement choisies et des critères de score détaillés ont été élaborés.
| Encadré. Critère de qualité a Participants
Rapporté
- 1. Description claire des critères d’inclusion et d’exclusion 7,17,18
Adéquat
- 2. Stratégie approfondie pour l'identification des cas potentiels 12
- 3. Taux de recrutement des patients >70% 12
- 4. Évaluation des non participants pour juger de la généralisation potentielle12
Objectifs et critères de jugement
Rapporté
- 5. Objectifs spécifiques et hypothèses17,18
- 6. Critères de jugement primaires et secondaires clairement définis 17,18
Adéquat
- 7. Utilisation de critères validés 12
- 8. Mise en aveugle vis-à-vis de l'attribution par groupe de ceux évaluant les critères 7,16
Mesures initiales et homogénéité
Rapporté
- 9. Caractéristiques démographiques à la ligne de base et cliniques de chaque groupe avant l’intervention12,18
- 10. Mesures des critères à la ligne de base de chaque groupe avant l'intervention16
Adéquat
- 11. Aucune différence significative actuelle dans les groupes de l'étude 7,16
Randomisation et mise en aveugle de l’assignation
Rapporté
- 12. Schéma de l’étude et méthode de randomisation, y compris des détails sur toute restriction (par exemple, blocage, stratification, appariement) 7,12,18
Adéquat
- 13. Méthode pour produire l'ordre de randomisation explicitement décrite et adéquate16
- 14a. L’unité d'affectation était par établissement, équipe, ou professionnel, et le nombre de groupes était adéquat (randomisation de groupe seulement) 19-21
- 14b. L'unité d'affectation était par patient et un schéma centralisé de randomisation était mis en place en appelant un numéro centralisé, un système informatique sur place, ou des enveloppes opaques scellées (randomisation individuelle seulement) 16
Taille de l’échantillon et abandons
Rapporté
- 15. Comment la taille de l'échantillon était déterminée et, si applicable, explication des analyses intérmédiaires17,18
- 16. Distribution des participants à chaque stade 17,18
Adéquat
- 17. Dimension de l'échantillon prévue atteinte à la ligne de base et basée sur un calcul de la taille adéquate de l'échantillon 12
- 18. Mesures de résultats obtenues pour 90% à 100% des participants (« oui ") ou 70% à 89% (« partiel ") randomisés (indiqué explicitement) 7,12,16
Intervention, témoins et protection contre une contamination
Rapporté
- 19. Détails précis de l'intervention et la façon et le moment de l’administration7,12,17,18
- 20. Détails précis des témoins (contraste entre l'intervention et les témoins bien défini) 12
Adéquat
- 21. Il est peu probable que les patients témoins aient reçu l'intervention à l’étude ou une intervention semblable 7,12,16
- 22. Il est documenté que les patients de l’intervention ont réellement reçu l'intervention12
Analyses
Rapporté
- 23. Méthodes statistiques employées pour comparer des groupes pour les critères primaires et secondaires et pour les analyses de sous-groupe, si pertinent17,18
- 24. Pour chaque critère primaire et secondaire, résumé des résultats pour chaque groupe, effet taille estimé et précision prévues (par exemple, valeur de P ou intervalle de confiance à 95%) 18
Adéquat
- 25. Analyse en « intention de traiter » (l'analyse est exécutée sur des groupes produits au début par le processus de randomisation) et, dans les études par groupes, explication de la variation entre groupe 18,20,22
a Chacun des 25 articles est scoré 4 (notes complètes), 2 (notes partielles), ou 0.
|
|
La qualité des études était évaluée indépendamment par 2 relecteurs (C.Z. et G.R.) ; les anomalies étaient résolues par discussion et, au besoin, par consensus avec un troisième relecteur (I.T.). Le taux de recrutement pour chaque étude a été calculé en divisant le nombre de patients ayant accompli des mesures à la ligne de base par le nombre éligible. La perte de vue lors du suivi a été calculée séparément pour les résultats de la qualité de vie et de la satisfaction et pour les résultats économiques et des services de santé, en divisant le nombre de patients pour lesquels les mesures de résultats étaient disponibles par le nombre de patients pour lesquels les valeurs à la ligne de base étaient enregistrées.
Nous avons analysé les études séparément pour les résultats de la qualité de vie, la satisfaction du patient et de sa famille concernant les soins, et le coût économique. Les études étaient trop hétérogènes pour permettre une mise en commun statistique ; nous avons donc exécuté une synthèse qualitative des études, prenant en considération la puissance de l'étude et la qualité méthodologique dans l'analyse et le rapport de nos résultats.14
RESULTATS
Sélection des études
Notre recherche initiale a identifié 697 différents articles, dont 396 étaient des rapports de RCT (FIGURE). De ces derniers, 128 évaluaient la chimiothérapie ou les agents hormonaux ; 81 évaluaient les procédures dirigées contre le cancer ou une radiothérapie; 64 médicaments, la douleur et les symptômes ; 24 évaluaient des médicaments ou des procédures cardiaques; 22 des médicaments ou des procédures médicales pour des maladies autres qu’une cardiopathie ou un cancer ; 21 ont évalué des thérapies complémentaires (par exemple, massage, hypnose, guérison spirituelle, réflexologie, aromathérapie) ; et 27 des interventions de services de soins (par exemple, listes rapides, entrevues sur bande audio, directives anticipées, programmes informatiques interactifs). Vingt-neuf articles ont rendu compte de 23 différents RCT évaluant les soins palliatifs spécialisés.28-51 Un a été exclu parce qu'il n’était disponible qu’en chinois 50 et un autre parce qu'il n’avait inclus que 9 patients et aucune donnée quantitative.51 Une autre étude 47 a été identifiée manuellement en cherchant les références des 27 autres articles. Des 22 différentes études, 13 n'avaient jamais été incluses dans une revue précédente, 28-37,39,40,43 et 1 n’avait été précédemment revue que par son auteur.38
|
|

|
Figure. Diagramme de distribution du processus de sélection des études
|
|
|
Caractéristiques des études
Les 22 études ont pris en compte les années 1984-2007 et ont eu une taille d'échantillon médiane de 204 (extrêmes, 69-4804 ; TABLEAU 1). Trois études ont été identifiées de 1980-1989, 6 de 1990-1999, et 13 de 2000-2007. Toutes sauf 6 ont été basées aux Etats-Unis ; 4 ont été conduites au Royaume-Uni, 36,37,41,46 et 1 en Norvège38 et au Canada. 44 Bien que la plupart des études aient été individuellement randomisées, une randomisation par groupes a été utilisée par 4 études, 35,38,43,46 avec un nombre de sous-groupes dans chaque groupe allant de 1 35 à plus de 70. 46 Onze études ont été conduites à domicile, 28,29,32,39,41,44-48,61 5 en consultations externes, 30,33,35,36,42 1 dans une maison médicalisée 34 et dans un contexte hospitalier et à domicile combiné.31 et 4 à la maison. 37,40,43,49 Onze ont inclus presque exclusivement des patients ayant un cancer 28,30,36,37,42,44-47,49,61 ; 8 ont évalué des patients ayant un cancer et d'autres diagnostics, y compris une insuffisance cardiaque chronique (CHF), une maladie pulmonaire chronique obstructive (BPCO), une maladie du neurone moteur, et le sida.29,31,33,35,39,43,48,59 Deux ont étudié une population gériatrique, 34,40 et 1 n’avait inclus que des patients ayant une CHF ou une BPCO.32 Dans 12 études, l'intervention se composait d'une équipe multidisciplinaire (>3 spécialités) ; 4 études ont évalué les soins infirmiers 28,36,43,59 ; 1 a évalué une intervention par un médecin et une équipe d'infirmières 40 et 2 études ont évalué des interventions de conseils: une administrés par un travailleur social42 et l'autre par une personne qualifiée.33 Les 3 études demeurant ont évalué des services coordonnés de soin, dont 2 avec un coordonnateur infirmière ou travailleur social.31,46 La troisième a évalué un service qui estimait l'éligibilité des patients pour admission dans un hospice et la référence comme étant appropriée.34
|
|

|
Tableau 1. Caractéristiques des essais sélectionnés évaluant l’efficacité des services de soin palliatif spécialisés
|
|
|
Qualité de vie
La qualité de vie des patients était une mesure dans 13 études et un critère primaire spécifié dans 4 d’entre elles30,36-38 (TABLEAU 1). Quatre études ont évalué la qualité de vie des soignants.30,39,42,52 Plusieurs instruments ont été employés pour évaluer la qualité de vie : le Multidimensional Quality of Life Scale-Cancer Version 62; l’European Organisation for Research and Treatment of Cancer (EORTC) QLQ-C30, utilisé dans 3 studies63 ; le Medical Outcomes Study Short Form (SF-36 ou SF-20), utilisé dans 3 studies64 ; le Functional Living Index-Cancer65; le Sickness Impact Profile66; le General Health Rating Index67; le Hospice Quality of Life Index68; le Spitzer Quality of Life Index and Uniscale, chacun dans une étude 69; et le Caregiver Quality of Life Index-Cancer. 70 Seule 1 des études a employé une mesure de la qualité de vie spécifique à une population de soins palliatifs, 68 et 1 étude a employé une mesure spécifique du cancer quoique 70% des patients aient une BPCO ou une CHF avancés.35
Toutes sauf 4 études sur les 13 30,32,36,39 n'ont rapporté aucune différence significative dans la qualité de vie entre les groupes randomisés, et 1 étude était en faveur des témoins.47 Cependant, toutes sauf 1 30 manquaient de puissance pour détecter les différences de la qualité de vie, en raison de la taille initiale insuffisante de l'échantillon ou des niveaux élevés des pertes de vue lors du suivi. Seules 3 études étaient spécifiquement conçues pour avoir une puissance permettant de détecter des différences significatives dans la qualité de vie, 30,36,38 mais 1 d'entre elles n'avait pas fait d’ajustement de la taille de l'échantillon ciblé à la randomisation des groupes, 38 et 2 n’étaient pas ajustées pour les pertes de vue lors du suivi de 70% et de 56%, respectivement. 36,38 Dans une des dernières études où manquaient des scores de qualité de vie, des valeurs imputées ont été assignées, 38 mais l'interprétation est difficile avec un si grand pourcentage de données absentes.
Deux études évaluant des programmes de soins palliatifs à domicile à l’aide du questionnaire SF-36 ont indiqué des différences de qualité de vie significatives chez les patients en faveur des soins palliatifs. Une étude a trouvé des différences significatives pour 6 domaines sur 8 utilisant des analyses de covariance. Les coefficients de l’effet traitement ont été les suivants : fonction du rôle émotionnel, 12.7 (P<0.001) ; fonction sociale, 0.6 (P=0.03) ; douleur corporelle, 2.4 (P=0.02) ; santé mentale, 3.0 (P=0.008) ; vitalité, 1.8 (P=0.05) ; et santé générale, 0.9 (P=0.03).39 L'autre étude a indiqué des résultats significatifs pour seulement 2 domaines sur 8 en utilisant la différence de la pente moyenne pour comparer le groupe d'intervention au groupe témoin avec le temps : fonction physique, 0.18 contre –1.39 pour les patients ayant une CHF et 1.00 contre –0.95 pour les patients ayant une COPD, P<0.05 ; et santé générale, 0.16 contre –0.17 et 0.54 contre –1.67, P<0.05, respectivement.32
Dans une étude avec un suivi mené par des infirmières sur des patients ayant un cancer du poumon avec l'EORTC QLQ-C30, une amélioration de la fonction émotionnelle a été observée dans le groupe intervention contre le groupe témoin à 12 mois (scores médians, 91.7 contre 66.7 ; P=0.03) ; cependant, 70% des patients ont été perdus de vue lors du suivi.36 Cette étude mesurait aussi la dyspnée en tant qu'élément du EORTC QLQ-C30 Lung Module et a trouvé un avantage significatif chez les patients du groupe intervention à 3 mois (médiane, 25.0 contre 33.3 ; P=0.03). Une étude avec une intervention multidisciplinaire structurée de trois semaines chez des patients en radiothérapie, qui évaluait la qualité de vie des patients utilisant une échelle analogue linéaire à simple élément, a trouvé un score significativement meilleur dans le groupe intervention à 4 semaines (moyenne, 72.8 contre 64.1 ; P=0.047) mais pas à 8 ou 27 semaines.30 La qualité de vie des travailleurs sociaux a été également mesurée dans cette étude, mais les résultats n'étaient pas significatifs. Deux études additionnelles ont évalué la qualité de vie des travailleurs sociaux utilisant des interventions conçues spécifiquement pour des travailleurs sociaux. 42,52 Une d’elles utilisait des modèles de régression des effets aléatoires pour mesurer les différences du Caregiver Quality of Life Index-Cancer entre les groupes et a trouvé un avantage significatif de l'intervention à 30 jours ou à 2 semaines après l’intervention (interaction temps x groupe : évaluation 0.096, P=0.04) 52 ; cependant, le taux d’abandons était à ce moment-là de 63%, résultant en un biais possible de rétention.
Quatorze études ont spécifiquement évalué les symptômes, certaines utilisant la détresse globale des symptômes ou une mesure de la sévérité 28,30,32,46,47,49 et d'autres utilisant des échelles pour des symptômes tels que la douleur, 28,35,43,44,47,58 la nausée, 44 la constipation, 28 la dyspnée, 28,35 le sommeil, 35 l'anxiété, 33,35,42,46,71 et la dépression ou le moral.30,33,35,42,45-48,71 Seule 1 étude a démontré un avantage des interventions de soins palliatifs pour tout symptôme mesuré. Cette étude évaluait l’efficacité d'un service de consultation de soin palliatif pour des patients ayant un cancer, une BPCO, et une CHF utilisant des analyses de la covariance avec 9 mesures de résultats, y compris celles de la dyspnée, de la douleur, du sommeil, de l’anxiété, et de la dépression. Il y a eu une amélioration du groupe intervention comparé aux groupe témoin seulement pour la fréquence de limite des activités par la dyspnée (interaction temps x groupe, F=6.83, P=0.01) avec des résultats limite pour l'anxiété (F=4.09, P=0.05).35 Cette étude avait des insuffisances méthodologiques dont l’absence de définition d’une critère primaire, l'utilisation d’une randomisation par groupe avec seulement 2 groupes, et le déséquilibre des hommes et des femmes dans les groupes comparateurs.
Dans 3 études, les résultats ont été en faveur de l'intervention pour la détresse due aux symptômes mais pas pour la sévérité des symptômes. Une étude de patients ayant un cancer de poumon a évalué la détresse due aux symptômes, les perceptions de l’état de santé, l'humeur, et la douleur.47 Bien que le groupe de soin en consultation (groupe témoin) ait éprouvé des scores moyens élevés de détresse due aux symptômes 6 semaines plus tôt que ce que le groupe de soins combinés oncologiques à domicile et les groupes standard de soin à domicile ont éprouvé (F=5.01, P=0.03), les perceptions sur l’état de santé se sont améliorés paradoxalement dans le groupe témoin avec le temps et ont diminué dans les groupes d'intervention combinée (F=4.06, P=0.05). La deuxième étude 32 a mesuré le contrôle des symptômes en utilisant des articles de la Memorial Symptom Assessment Scale 72 pour évaluer l'efficacité d'une équipe de soins palliatifs à domicile chez des patients ayant une CCF et une BPCO. À 3 mois, les patients ayant une BPCO qui recevaient l'intervention d’une équipe interdisciplinaire avaient des scores inférieurs de détresse due aux symptômes (scores moyens, 3.4 contre 4.29, P<0.05) et tendu à avoir les points inférieurs à 6 mois (scores moyens, 2.85 contre 3.80, P<0.07). Cependant, les patients ayant une CCF ont eu des scores équivalents ou plus élevés dans les groupes d'intervention et témoins aux deux temps de mesure (scores moyens, 3.72 contre 3.32 ; P=NS à 3 mois ; 4.03 contre 3.30 ; P<0.05 à 6 mois). Une troisième étude a évalué l'effet sur des patients d'une intervention de prise en charge de leurs soignants.28 La sévérité des symptômes et la qualité de vie ne se sont pas améliorées, mais la détresse due aux symptômes a sensiblement diminuée avec le temps dans le groupe d'intervention comparé au groupe témoin (soins en hospice) (modèles de régression des effets aléatoires, interaction groupe x temps, –0.101; P=0.009).
Satisfaction avec les soins
La satisfaction des patients avec les soins a été évaluée dans 10 études, entreprises à domicile, l'hôpital, et chez des patients ambulatoires aux Etats-Unis et au Royaume-Uni (Tableau 1). 29,31,35-37,39,45,46,48,49 Quatre études ont montré une satisfaction sensiblement accrue dans les groupes intervention comparés au groupe témoin.29,31,36,49 Une étude—le premier RCT à examiner l'efficacité des soins en hospice aux Etats-Unis— a utilisé des analyses répétées de mesures avec 5 cohortes des patients définies selon le nombre minimum d'entrevues accompli (3-7 entrevues sur 18 semaines) 49 ; il y avait statistiquement une augmentation significative de la satisfaction pour les soins interpersonnels (échelle de Ware adaptée) dans le groupe intervention dans toutes les cohortes. Deux études utilisant des mesures ad hoc ont trouvé une satisfaction accrue pour les soins à 3 mois dans le groupe intervention comparé aux témoins.31,36
Une étude sur des soins de santé interdisciplinaires à domicile pour des patients confinés à la maison a montré une satisfaction accrue dans le groupe intervention à 30 jours (rapport de cotes [OR], 3.37 ; intervalle de confiance à 95% [IC], 1.42-8.10 ; P=0.006) et 90 jours (OR, 3.37 ; IC 95%, 0.65-4.96 ; P=0.03), mais pas à 60 jours (OR, 1.79 ; IC 95%, 0.65-4.96 ; P=0.26). Cependant, les mesures à la ligne de base n'étaient pas équilibrées, avec une satisfaction sensiblement plus élevée pour les soins à la ligne de base dans le groupe intervention (mesuré après que les résultats de la randomisation aient été révélés).29 Dans toutes les études restantes, les résultats n'étaient pas statistiquement significatifs. Cependant, toutes ces études ont été affectées par des pertes de vue importantes lors du suivi et ont diminué la puissance statistique.
Les évaluations de la satisfaction des soignants ont montré un avantage statistiquement significatif chez les soignants dans le groupe intervention dans 7 des 10 études 34,39,43,45,48,49,60 mais pas dans 3 études. 37,46,59 Trois 34,43,60 des 5 études ayant évalué les soignants après le décès du patient34,37,43,59,60 et les 4 études mesurant la satisfaction du soignant longitudinalement au cours de l'étude ont rapporté une plus grande satisfaction chez ceux du groupe intervention. Une étude qui a évalué la satisfaction à la fois longitudinalement et après le décès 46 n'a pas montré de différences significatives.
Coût économique et utilisation des services de santé
Le coût économique a été mesuré seulement dans 7 études, 29,31,36,39,45,48,49 tandis que les 22 études sauf 6 ont évalué l'utilisation des services de santé (tableau 1). 28,30,33,42,44,46 Les critères de jugement pour l'utilisation (ou l’évitement) des services de santé ont inclus le nombre de visites aux Urgences, 29,32,45,48 le nombre et/ou la durée des hospitalisations, 29,32,34,36,37,39,40,43,45,47-49 l’utilisation des ressources de l’hôpital, 36,37,40,43,49 la planification anticipée des soins, 31,32,35,40,43 la référence dans un hospice, 34 le décès à domicile, 29,36,41,49,61 et le temps passé à domicile.41,49,61
Toutes les études sauf 1 mesurant directement le coût des soins étaient basées aux Etats-Unis. La seule étude faite au Royaume-Uni n'a trouvé aucune différence significative pour les coûts globaux des soins pour le suivi dans les soins confiés à une infirmière comparé au suivi médical standard de patients ayant un cancer du poumon (coût médian par patient à 12 mois, $696.50 contre $744.50 ; P = 0.66).36 La seule étude aux USA ayant des résultats significatifs pour le coût était une étude récente de soin palliatif à domicile dans 2 HMO (organismes de santé) dans deux états.29 Les coûts globaux étaient sensiblement inférieurs chez les patients du groupe intervention que chez les patients du groupe de soins habituels (coût moyen par jour, $95.30 contre $212.80 ; P = 0.02), même après ajustement sur la survie sensiblement plus courte dans le groupe d'intervention (196 jours contre 242 jours). Deux autres études, une évaluant des soins de type hospitalisation à domicile des VA 45 et l'autre une équipe de soins à domicile, 48 a constaté que les coûts totaux d’hôpital étaient plus importants dans le groupe témoin tandis que les coûts totaux des soins à domicile étaient plus élevés dans le groupe d'intervention. Dans les deux études, comme dans une étude plus récente évaluant les résultats économiques de patients dans 3 centres médicaux de la VA, 31 les coûts globaux par habitant étaient inférieurs dans le groupe d'intervention, mais les résultats n'atteignaient pas de signification statistique.
Des résultats contradictoires ont été trouvés dans une étude antérieure portant sur les soins en hospice de la VA, 49 n’ayant mesuré que le coût des jours d'hôpital et des procédures thérapeutiques. Bien que cette étude ait exclu le coût des soins à domicile, les dépenses moyennes pour le groupe d'intervention étaient au moins aussi élevées que celles du groupe témoin ($15 263 contre $15 493, si on suppose que le coût d'un jour d'hospice est équivalent à celui d'un jour dans un service de soins intermédiaires, ou $17 770 contre $15 493, si un jour d'hospice est équivalent à un jour dans un service de médecine générale). Une autre étude a évalué l'efficacité des soins primaires à domicile par une équipe de la VA 39 et a constaté que les coûts totaux étaient 12.1% plus élevés dans le groupe intervention que dans le groupe de soins habituels de la VA à 12 mois (moyenne, $31 401 contre $28 008 ; P=0.005).
Seulement 1 des études évaluant l'utilisation des services de soins a trouvé des différences uniformément significatives en faveur du groupe d'intervention. Dans cette étude, 205 résidents de maison médicalisées ont été randomisés vers (ou pas) une entrevue structurée identifiant ceux qui étaient éligibles pour l’hospice, suivi d'une demande au médecin des résidents d'autorisation d'une visite d’information à un hospice. Ceux dans le groupe d'intervention ont eu une inclusion plus élevée dans les hospices (25% vs 6%; P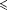 0.001), moins d'admissions en urgence (moyenne, 0.28 contre 0.49 ; P = 0.04), et moins de jours passés dans un contexte de soin aigu (moyenne, 1.2 contre 3.0 ; ).34 Une autre étude P=0.03 a rapporté une réduction de la durée de séjour dans un centre de soin aigu pour le groupe d'intervention (jours moyens d'hospitalisation, 9.94 contre 15.86 ; P=0.03).45 0.001), moins d'admissions en urgence (moyenne, 0.28 contre 0.49 ; P = 0.04), et moins de jours passés dans un contexte de soin aigu (moyenne, 1.2 contre 3.0 ; ).34 Une autre étude P=0.03 a rapporté une réduction de la durée de séjour dans un centre de soin aigu pour le groupe d'intervention (jours moyens d'hospitalisation, 9.94 contre 15.86 ; P=0.03).45
Parmi 9 autres études analysant le nombre d’admissions à l’hôpital,29,32,36,37,39,40,45,47,73 seule 1 avait des résultats significatifs en faveur du groupe d'intervention (36% contre 59% des patients hospitalisés ; P = 0.001).29 Les résultats pour le nombre de consultation en urgence étaient mélangés. Une étude évaluant une équipe de soin à domicile a trouvé que les patients du groupe d'intervention avaient eu une utilisation moyenne par patient par mois pour les jours à risque au cours des 6 premiers mois de 0.26 visite par les services d’urgence contre 0.05 dans le groupe témoin (P<0.05).48 Une deuxième étude a observé moins de visites aux Urgences dans le groupe d'intervention (différence de 35%, P=0.02).29 Deux autres études n’ont pas rapporté de différence significative entre les groupes randomisés.32,45
Cinq études ont évalué les décès à domicile, 29,36,41,49,61 qui était le critère primaire pour 2 d’entre elles.41,61 Trois études ont rapporté que plus de patients dans le groupe d'intervention étaient décédés à domicile que chez les patients du groupe témoin (Etats-Unis, 29 71% contre 51% ; P<0.001 ; Royaume-Uni, 36 40% contre 23% ; P=0.04 ; Norvège, 61 25% contre 15% ; P<0.05). L’étude norvégienne 61 a également mesuré le temps passé à domicile, qui n'avait pas sensiblement augmenté. Une étude aux USA sur les soins en hospice de la VA n'a trouvé aucune différence significative pour les décès à domicile entre les groupes intervention (3%) et les groupes témoin (7%).49 Dans une étude britannique ayant évalué l'efficacité de « l’hospitalisation à domicile, » 41 58% des patients de référence étaient décédés à la maison contre 67% dans le groupe intervention. Cette différence n'était pas significative, mais l'étude était de faible puissance, et 39% des patients randomisés dans le groupe «hospitalisation à domicile» n'avaient pas été admis dans le service, ayant pour résultat une dilution des effets lors de l’analyse en intention de traiter.
Evaluation de la qualité des études
Les RCT étaient de qualité variable, 11 (50%) scorant 60 points ou plus sur 100. Chacune des 11 études étant publiée depuis 1994, et les 8 études avec un score de 70 ou plus avaient été publiées depuis 2000. Les plus grandes difficultés concernaient le recrutement, les abandons, et la documentation concernant la génération et l'exécution de la séquence de randomisation. Les autres détails sont fournis ci-dessous (TABLEAU 2).
|
|

|
Tableau 2. Scores de qualité des essais évaluant l'efficacité des études sur les services de soins palliatifs spécialisés a
|
|
|
Participants et recrutement. Beaucoup d'études sont fondées sur des références de patients, plutôt que des cas potentiellement éligibles systématiquement issus d’un dépistage. Le taux médian de recrutement a été de 60% (extrêmes, 18%-94%, études n=17). Pour 5 études le taux de recrutement était impossible à déterminer car le nombre de patients éligibles n'était pas donné.31,40,43,46,61
Seules 4 études avaient évalué des non participants pour juger du potentiel de généralisation de leurs résultats ou comparé la démographie à la ligne de base de leurs patients aux statistiques publiées pour la population générale qu'elles étudiaient. 34,37,42,47 Dans une étude, les patients recrutés étaient plus jeunes que la population générale des patients atteints de cancer du poumon 47 ; dans une autre, les participants avaient moins de probabilité d’avoir Medicaid (24% contre 55%) ou un ordre de ne pas «ressusciter» (37% contre 53%) 34 ; un autre a cependant montré que les patients non randomisés allaient moins bien et avaient eu une survie plus courte.37 Il y avait ainsi une tendance à exclure les patients qui pouvaient bénéficier le plus d'une intervention de soins palliatifs.
Objectifs, résultats, et homogénéité. Des mesures validées des résultats ont été employées dans presque toutes les études, mais il n’y a eu une mise en aveugle du personnel de recherche envers l'assignation du groupe ayant interviewé les patients que dans 9 études.29,31,32,37,40,42-44,46 Seules 11 études ont clairement identifié des mesures de critères primaires,29,30,34,36,37,43-45,52,59,61 et 2 de ces dernières spécifiaient plus de 3 critères primaires.37,43
Randomisation, taille de l’échantillon, et abandons. La méthode pour produire la séquence de randomisation n’était adéquatement décrite que dans 8 études sur 18 individuellement randomisées 29,31,34,36,37,41,44,52 et la méthode pour la mettre en application que dans 7 études. 29,31,36,37,41,44,52 Dans 2 études sur 4 études de randomisation par groupe, 35,38 le nombre de groupes n'était pas adéquat (6 et 2 groupes totaux, respectivement). Des 11 études utilisant une randomisation individuelle, seulement 5 avaient décrit un calcul formel de la taille de l'échantillon, 34,37,41,44,49 et parmi celles-ci, 3 seulement avaient atteint la taille prévue d’échantillon.34,37,49 Bien que chacun des 4 essais de randomisation par groupe ait rapporté un tel calcul, il n’était pas fait mention du coefficient de corrélation intragroupe ou de la taille du groupe dans 3 d’entre elles.35,43,46 L'étude restante de randomisation par groupe a reconnu que la taille du groupe et la corrélation intragroupe devaient prises en compte, mais a néanmoins basé la taille de l'échantillon prévue sur des considérations pratiques et économiques.38
La perte de vue lors du suivi a été beaucoup plus importante pour les résultats concernant la qualité de vie et la satisfaction (médiane, 40% ; extrêmes, 3% - 92% ; n= 20 études) que pour les résultats économiques et l'usage des services de soins (médiane, 14% ; extrêmes, 0% - 53% ; n=16 études). Ceci était prévu, compte tenu de la possibilité d’une évaluation objective de ces derniers résultats comparés aux premiers, qui doit être réalisée avec le patient ou le travailleur social.
Contamination et analyses. Dans beaucoup d’études individuellement randomisées, il y avait un potentiel de contamination dans le groupe témoin parce que le même groupe de médecins s’occupait des patients du groupe d'intervention et témoins, 30,33,34,36,40 parce que des soins semblables à l'intervention pouvaient être obtenus ailleurs, 29,32,39,42,45,47,59 ou en raison du croisement explicite des témoins vers le groupe intervention.31,37,44 Parmi les 4 études de randomisation par groupe, 2 études incluaient des groupes témoins et d'intervention dans le même hôpital, 35,43 et dans 1 étude, quelques groupes témoins étaient transférés au groupe d'intervention durant l’essai.46 La plupart des études utilisaient des analyses en intention-de-traiter, mais la variation entre groupes n’a été expliquée dans l'analyse que pour 1 étude sur les 4 études de randomisation par groupe.38
COMMENTAIRE
 |  |
Il n’y a que des preuves limitées en faveur de l'efficacité des soins palliatifs spécialisés chez les patients ayant une maladie terminale en termes de qualité de vie, satisfaction du patient et du soignant, ou du coût économique. Parmi ces résultats, il n’y a de preuves constantes que pour une meilleure satisfaction du soignant. Cependant, la base de ces preuves est mince, et nous avons été incapables d’employer des méthodes formelles de regroupement méta-analytiques en raison de l'hétérogénéité des études, des interventions, et des résultats. Etant donné le nombre de comparaisons statistiques décrites dans notre revue, certains des résultats ayant une signification limite pourraient être dus au hasard. En outre, les études ont été gênées par les problèmes méthodologiques, qui limitent la qualité des preuves et des conclusions qui peuvent être tirées.
Un calcul approprié de la taille de l'échantillon n'a pas été fait dans de nombreuses études, donnant des études de faible puissance. Un tel calcul devrait prendre en considération les abandons, le manque de remplissage des questionnaires, la pénétration limitée potentielle de l'intervention, et la contamination du groupe témoin dans les études individuelles randomisées ou la corrélation intragroupe si une randomisation par groupe est utilisée.74 Dans de nombreuses études, les patients étaient randomisés après référence à un service de soin palliatif. Cette méthode de recrutement engendre des difficultés concernant les abandons et l’observance dans une population frêle avec un pronostic typique de 2 mois ou moins.75,76 Par ailleurs, une fois que les patients sont adressés à des soins palliatifs, on s'attend généralement à ce qu'ils soient vus immédiatement. Cette absence perçue d'équilibre peut causer une contamination ou une co-intervention, dues au transfert du groupe témoin au groupe d'intervention ou un service semblable. Réciproquement, il peut y avoir des patients qui ne sont pas référés mais qui pourraient également tirer un bénéfice des soins palliatifs. Les futures études devraient employer des critères d'éligibilité pour le statut pronostique et fonctionnel et identifier les participants potentiels à l’aide d’un dépistage actif par le personnel de recherche.77
Plusieurs études ont employé une randomisation par groupe pour éviter une contamination des témoins. Cependant, de telles études exigent un soin particulier dans leur conception et analyse afin de produire des résultats valides. Aucun des RCT par groupe n'a revu l’explication du regroupement dans le calcul de la taille de l'échantillon, ce qui a eu pour résultat une sous-estimation de la taille de l'échantillon, une perte de puissance, et une erreur de type-2.19 Trois des 4 RCT par groupe n'ont pas expliqué le regroupement dans les analyses. Bien que ceci puisse entraîner une erreur de type 1, les résultats de ces essais n'étaient pas statistiquement significatifs. De telles erreurs dans la conception des études randomisées par groupes sont communes 23,24,78,79 et ont mené à la construction des directives CONSORT modifiées dans leur rapport.22
Seule la moitié des études a identifié un critère primaire d’évaluation des résultats ; ceci peut mener à des conclusions invalides en raison des tests multiples de signification. La qualité de vie a été fréquemment choisie comme critère d’évaluation de l'efficacité des soins palliatifs, ce qui est approprié compte tenu de son importance dans les rapports de mission des organismes de soins palliatifs nationaux et internationaux. 80,81 Cependant, les mesures existantes validées et employées couramment pour évaluer la qualité de vie n'ont pas été développées pour les patients ayant une maladie terminale.63,82,83 Chez ces individus, une plus grande emphase devrait être mise probablement sur les soucis existentiels et spirituels, une communication efficace, et la planification et préparation à la fin de vie.84-86 Bien que des questionnaires de qualité de vie aient été développés pour les patients ayant une maladie terminale, 87-89 leur réponse aux changements et la différence minimale cliniquement importante sont jusqu'ici inconnues et davantage de recherches sont nécessaires.11,90 Des mesures spécifiques évaluant les symptômes ont été recommandées comme critères alternatifs d’évaluation aux échelles multidimensionnelles de la qualité de vie.90 Cependant, les résultats doivent être choisis pour refléter les soins qui sont donnés par l'intervention et l'évaluation des symptômes spécifiques peut ne pas refléter le large mandat des services de soins palliatifs spécialisés destinés à augmenter la qualité de vie chez les patients ayant une maladie terminale.
La satisfaction des patients et des soignants est un indicateur important de la qualité de vie.91,92 Cependant, l’évaluation de la satisfaction concernant les soins peut être problématique, en raison de l'effet de plafonnement des cotations de satisfaction généralement élevées, de la variabilité subjective pour définir des soins satisfaisants, et de la possibilité de satisfaction avec des soins qui sont sous-optimaux selon des normes établies.93,94 Nous avons constaté que la satisfaction des soignants était un des résultats montrant une amélioration consistante dans les études que nous avons revues. À la ligne de base, les soignants tendent à évaluer les soins moins favorablement que les patients, ce qui peut refléter une différence dans des aspects de soin considérés comme étant importants ou une réticence des patients pour critiquer leur soignants.94,95 Par conséquent, il peut y avoir plus d’opportunité pour améliorer les scores du soignant, avec une tendance moindre à un effet plafond. Il peut également être préférable de mesurer la satisfaction d'une façon continue dans toute l'étude, car les entrevues après le décès peuvent être sujettes à des biais de rappel 92 et il peut être difficile d’entrer en contact avec des familles en deuil.
La perception de coûts élevés des soins de fin de vie dans les pays développés ont mené à un désir d'augmenter leur efficacité et leur rentabilité.96 Six des 7 RCT mesurant directement le coût ont été conduits aux Etats-Unis et ont prouvé que les coûts à l’hôpital généralement diminuent, tandis que les coûts des soins à domicile et en hospice augmentent, lorsque les patients ont été adressés à un programme de soin palliatif. Bien qu'il n’y ait que des preuves minimales pour démontrer des économies globales des programmes de soins palliatifs, les études n'ont pas défini ou mesuré la rentabilité. Par ailleurs, les analyses de coût traditionnelles mesurées en années de vie ajustées sur la qualité peuvent ne pas être appropriées dans des programmes de soin en fin de vie, compte tenu de la courte durée des soins fournie et de la valeur sociale et personnelle considérable placée sur la qualité.97 En outre, les études n'ont pas évalué les coûts personnels importants qui peuvent être engagés par les patients et les membres de leur famille, dont les dépenses médicamenteuses, pour le transport, pour les aménagements à domicile, les soins personnels, et la perte de revenus.98 Les soignants peuvent également éprouver une morbidité physique et psychologique substantielle ou même une mortalité en raison de la charge de travail.99,100 Avec son emphase sur les soins holistiques, le soin palliatif spécialisé a le potentiel de diminuer ces coûts pour le patient et la famille, et une attention devrait être accordée à la mesure de ces critères dans les RCT futurs.
Bien que l'accès à des programmes de soins palliatifs spécialisés ait augmenté rapidement dans le monde développé, une évaluation rigoureuse de ces programmes est difficile et récente. Les études existantes ne fournissent pas la preuve concluante, et les études soigneusement planifiées, utilisant une intervention de soins palliatifs normalisés et des critères spécifiquement construits pour cette population, sont nécessaires. L'évaluation des traitements spécifiques administrés dans les soins palliatifs, tel que les opiacés ou les agents non stéroïdiens pour contrôler la douleur, ou la psychothérapie pour une dépression, étaient hors des objectifs de cette étude, mais a récemment été revue.101 De récentes études pilotes évaluant les soins palliatifs précoces chez des patients ayant un cancer terminal sont encourageantes.102,103 Davantage de recherches sont nécessaires pour justifier ces résultats chez les patients ayant d'autres maladies à l’aide d’épreuves randomisées plus larges.
Informations sur les auteurs
Correspondance: Camilla Zimmermann, MD, MSc, Palliative Care Services, Department of Psychosocial Oncology and Palliative Care, Princess Margaret Hospital, 610 University Ave, 16-712, Toronto, ON, Canada M5G 2M9( camilla.zimmermann{at}uhn.on.ca).
Contributions des auteurs: Le Dr. Zimmermann a eu un accès complet à toutes les données de l'étude et accepte la responsabilité de l'intégrité des données et de l'exactitude de l'analyse de données.
Conception et schéma de l’étude: Zimmermann, Riechelmann, Krzyzanowska, Rodin, Tannock.
Recueil des données: Zimmermann, Riechelmann, Rodin.
Analyse et interprétation des données: Zimmermann, Riechelmann, Krzyzanowska, Rodin, Tannock.
Rédaction du manuscrit: Zimmermann.
Revue critique du manuscrit: Zimmermann, Riechelmann, Krzyzanowska, Rodin, Tannock.
Analyse statistique: Zimmermann.
Obtention du financement: Zimmermann.
Aide administrative, technique ou matérielle: Riechelmann.
Supervision de l’étude: Zimmermann, Rodin, Tannock.
Liens financiers: Aucun rapporté.
Financement/soutien: Cette revue a été réalisée grâce à une bourse 017257 de l'Institut National contre le Cancer du Canada, avec des fonds de l'Association canadienne contre le cancer (Dr. Zimmermann).
Rôle du sponsor: L'agence de financement n'a joué aucun rôle dans la conception ou la conduite de l'étude ; la collection, l'analyse ou l'interprétation des données ; ou la préparation, la revue, ou l'approbation du manuscrit.
Affiliations des auteurs: Division of Medical Oncology and Hematology, Department of Medicine (Drs Zimmermann, Krzyzanowska, et Tannock) et Department of Psychiatry (Drs Zimmermann et Rodin), University of Toronto; Department of Psychosocial Oncology and Palliative Care (Drs Zimmermann et Rodin) et Department of Medical Oncology (Drs Krzyzanowska et Tannock), Princess Margaret Hospital, University Health Network, Toronto, Ontario, Canada; Department of Medical Oncology, Albert Einstein Hospital, Sao Paulo, Brazil (Dr Riechelmann).
FMC disponible en ligne à www.jamaarchivescme.com et questions p 1729.
BIBLIOGRAPHIE
 |  |
1. Addington-Hall J, McCarthy M. Dying from cancer. Palliat Med. 1995;9(4):295-305.
FREE FULL TEXT
2. McCarthy EP, Phillips RS, Zhong Z, Drews RE, Lynn J. Dying with cancer. J Am Geriatr Soc. 2000;48(5)(suppl):S110-S121.
PUBMED
3. Rodin G, Zimmermann C, Rydall A, et al. The desire for hastened death in patients with metastatic cancer. J Pain Symptom Manage. 2007;33(6):661-675.
PUBMED
4. Saunders C.. The moment of truth: care of the dying person. In: Pearson L, ed. Death and Dying: Current Issues in the Treatment of the Dying Person. Cleveland, OH: Case Western Reserve University Press; 1969:49-78.5. Sepu lveda C, Marlin A, Yoshida T, Ullrich A. Palliative care. J Pain Symptom Manage. 2002;24(2):91-96.
PUBMED
6. Higginson IJ, Finlay IG, Goodwin DM, et al. Is there evidence that palliative care teams alter end-of-life experiences of patients and their caregivers? J Pain Symptom Manage. 2003;25(2):150-168.
PUBMED
7. Smeenk FW, van Haastregt JC, de Witte LP, Crebolder HF. Effectiveness of home care programmes for patients with incurable cancer on their quality of life and time spent in hospital. BMJ. 1998;316(7149):1939-1944.
FREE FULL TEXT
8. Higginson IJ, Finlay I, Goodwin DM, et al. Do hospital- based palliative teams improve care for patients or families at the end of life? J Pain Symptom Manage. 2002;23(2):96-106.
PUBMED
9. Hearn J, Higginson IJ. Do specialist palliative care teams improve outcomes for cancer patients? Palliat Med. 1998;12(5):317-332.
FREE FULL TEXT
10. Salisbury C, Bosanquet N, Wilkinson EK, et al. The impact of different models of specialist palliative care on patients’ quality of life. Palliat Med. 1999;13(1):3-17.
FREE FULL TEXT
11. Kaasa S, Loge JH. Quality-of-life assessment in palliative care. Lancet Oncol. 2002;3(3):175-182.
PUBMED
12. Rinck GC, van den Bos GA, Kleijnen J, de Haes HJ, Schade E, Veenhof CH. Methodologic issues in effectiveness research on palliative cancer care. J Clin Oncol. 1997;15(4):1697-1707.
ABSTRACT
13. Jenicek M.. Where we are and where we want to go. J Clin Epidemiol. 1989;42(1):35-44.
PUBMED
14. Grimshaw J, McAuley LM, Bero LA, et al. Systematic reviews of the effectiveness of quality improvement strategies and programmes. Qual Saf Health Care. 2003;12(4):298-303.
FREE FULL TEXT
15. Effective Practice and Organization of Care Group (EPOC) [Web page]. http://www.epoc.uottawa.ca. 2007. Accessed August 27, 2007.16. Cochrane Effective Practice and Organization of Care Group (EPOC). Data abstraction template. http://www.epoc.cochrane.org/Files/Website/Reviewer%20Resources/Data%20Abstraction%20Form%20-%20EPOC%20-%202007-Feb-27.doc. Accessed April 4, 2007.17. Jadad AR, Moore RA, Carroll D, et al. Assessing the quality of reports of randomized clinical trials: is blinding necessary? Control Clin Trials. 1996;17(1):1-12.
PUBMED
18. Moher D, Schulz KF, Altman D. The CONSORT statement. JAMA. 2001;285(15):1987-1991.
FREE FULL TEXT
19. Donner A, Klar N. Design and Analysis of Cluster Randomization Trials in Health Research. London, England: Arnold; 2000.20. Kirkwood BR, Cousens SN, Victora CG, de Zoysa I. Issues in the design and interpretation of studies to evaluate the impact of community-based interventions. Trop Med Int Health. 1997;2(11):1022-1029.
PUBMED
21. Kirkwood BR, Morrow RH. Community-based intervention trials. J Biosoc Sci Suppl. 1989;10:79-86.
PUBMED
22. Campbell MK, Elbourne DR, Altman DG. CONSORT statement: extension to cluster randomised trials. BMJ. 2004;328(7441):702-708.
FREE FULL TEXT
23. Eldridge SM, Ashby D, Feder GS, Rudnicka AR, Ukoumunne OC. Lessons for cluster randomized trials in the twenty-first century. Clin Trials. 2004;1(1):80-90.
FREE FULL TEXT
24. Donner A, Brown KS, Brasher P. A methodological review of non-therapeutic intervention trials employing cluster randomization, 1979-1989. Int J Epidemiol. 1990;19(4):795-800.
FREE FULL TEXT
25. Campbell MK, Thomson S, Ramsay CR, et al. Sample size calculator for cluster randomized trials. Comput Biol Med. 2004;34(2):113-125.
PUBMED
26. Campbell MK, Mollison J, Steen N, et al. Analysis of cluster randomized trials in primary care. Fam Pract. 2000;17(2):192-196.
FREE FULL TEXT
27. Huwiler-Müntener K, Jüni P, Junker C, Egger M. Quality of reporting of randomized trials as a measure of methodologic quality. JAMA. 2002;287(21):2801-2804.
FREE FULL TEXT
28. McMillan SC, Small BJ. Using the COPE intervention for family caregivers to improve symptoms of hospice homecare patients. Oncol Nurs Forum. 2007;34(2):313-321.
PUBMED
29. Brumley R, Enguidanos S, Jamison P, et al. Increased satisfaction with care and lower costs. J Am Geriatr Soc. 2007;55(7):993-1000.
PUBMED
30. Rummans TA, Clark MM, Sloan JA, et al. Impacting quality of life for patients with advanced cancer with a structured multidisciplinary intervention. J Clin Oncol. 2006;24(4):635-642.
FREE FULL TEXT
31. Engelhardt JB, McClive-Reed KP, Toseland RW, Smith TL, Larson DG, Tobin DR. Effects of a program for coordinated care of advanced illness on patients, surrogates, and healthcare costs: a randomized trial. Am J Manag Care. 2006;12(2):93-100.
PUBMED
32. Aiken LS, Butner J, Lockhart CA, et al. Outcome evaluation of a randomized trial of the PhoenixCare intervention. J Palliat Med. 2006;9(1):111-126.
PUBMED
33. Miller DK, Chibnall JT, Videen SD, Duckro PN. Supportive- affective group experience for persons with life-threatening illness. J Palliat Med. 2005;8(2):333-343.
PUBMED
34. Casarett D, Karlawish J, Morales K, Crowley R, Mirsch T, Asch DA. Improving the use of hospice services in nursing homes. JAMA. 2005;294(2):211-217.
FREE FULL TEXT
35. Rabow MW, Dibble SL, Pantilat SZ, McPhee SJ. The comprehensive care team. Arch Intern Med. 2004;164(1):83-91.
FREE FULL TEXT
36. Moore S, Corner J, Haviland J, et al. Nurse led follow up and conventional medical follow up in management of patients with lung cancer. BMJ. 2002;325(7373):1145.
FREE FULL TEXT
37. Hanks GW, Robbins M, Sharp D, et al. The IMPACT study. Br J Cancer. 2002;87(7):733-739.
PUBMED
38. Jordhøy MS, Fayers P, Loge JH, Ahlner-Elmqvist M, Kaasa S. Quality of life in palliative cancer care. J Clin Oncol. 2001;19(18):3884-3894.
FREE FULL TEXT
39. Hughes SL, Weaver FM, Giobbie-Hurder A, et al. Effectiveness of team-managed home-based primary care. JAMA. 2000;284(22):2877-2885.
FREE FULL TEXT
40. Ahronheim JC, Morrison RS, Morris J, Baskin S, Meier DE. Palliative care in advanced dementia. J Palliat Med. 2000;3(3):265-273.
PUBMED
41. Grande GE, Todd CJ, Barclay SI, Farquhar MC. Does hospital at home for palliative care facilitate death at home? BMJ. 1999;319(7223):1472-1475.
FREE FULL TEXT
42. Toseland RW, Blanchard CG, McCallion P. A problem solving intervention for caregivers of cancer patients. Soc Sci Med. 1995;40(4):517-528.
PUBMED
43. The SUPPORT Principal Investigators. A controlled trial to improve care for seriously ill hospitalized patients. JAMA. 1995;274(20):1591-1598.
FREE FULL TEXT
44. McWhinney IR, Bass MJ, Donner A. Evaluation of a palliative care service: problems and pitfalls. BMJ. 1994;309(6965):1340-1342.
FREE FULL TEXT
45. Hughes SL, Cummings J, Weaver F, Manheim L, Braun B, Conrad K. A randomized trial of the cost effectiveness of VA hospital-based home care for the terminally ill. Health Serv Res. 1992;26(6):801-817.
PUBMED
46. Addington-Hall JM, MacDonald LD, Anderson HR, et al. Randomised controlled trial of effects of coordinating care for terminally ill cancer patients. BMJ. 1992;305(6865):1317-1322.
FREE FULL TEXT
47. McCorkle R, Benoliel JQ, Donaldson G, Georgiadou F, Moinpour C, Goodell B. A randomized clinical trial of home nursing care for lung cancer patients. Cancer. 1989;64(6):1375-1382.
PUBMED
48. Zimmer JG, Groth-Juncker A, McCusker J. A randomized controlled study of a home health care team. Am J Public Health. 1985;75(2):134-141.
FREE FULL TEXT
49. Kane RL, Wales J, Bernstein L, Leibowitz A, Kaplan S. A randomised controlled trial of hospice care. Lancet. 1984;1(8382):890-894.
PUBMED
50. Li YQ, Zhang MX, Fu GX, et al. Effect of hospice care on the quality of life and psychological state of aged mortal inpatients [in Chinese]. Zhong Nan Da Xue Xue Bao Yi Xue Ban. 2006;31(4):538-542.
PUBMED
51. Paes P.. A pilot study to assess the effectiveness of a palliative care clinic in improving the quality of life for patients with severe heart failure. Palliat Med. 2005;19(6):505-506.
FREE FULL TEXT
52. McMillan SC, Small BJ, Weitzner M, et al. Impact of coping skills intervention with family caregivers of hospice patients with cancer. Cancer. 2006;106(1):214-222.
PUBMED
53. Clark MM, Rummans TA, Sloan JA, et al. Quality of life of caregivers of patients with advanced-stage cancer. Am J Hosp Palliat Care. 2006;23(3):185-191.
FREE FULL TEXT
54. Desbiens NA, Wu AW, Broste SK, et al.; for the SUPPORT Investigators. Pain and satisfaction with pain control in seriously ill hospitalized adults. Crit Care Med. 1996;24(12):1953-1961.
PUBMED
55. Baker R, Wu AW, Teno JM, et al. Family satisfaction with end-of-life care in seriously ill hospitalized adults. J Am Geriatr Soc. 2000;48(5)(suppl):S61-S69.
PUBMED
56. Cummings JE, Hughes SL, Weaver FM, et al. Costeffectiveness of Veterans Administration hospitalbased home care. Arch Intern Med. 1990;150(6):1274-1280.
FREE FULL TEXT
57. Kane RL, Klein SJ, Bernstein L, Rothenberg R. The role of hospice in reducing the impact of bereavement. J Chronic Dis. 1986;39(9):735-742.
PUBMED
58. Kane RL, Berstein L, Wales J, Rothenberg R. Hospice effectiveness in controlling pain. JAMA. 1985;253(18):2683-2686.
FREE FULL TEXT
59. Grande GE, Todd CJ, Barclay SI, Farquhar MC. A randomized controlled trial of a hospital at home service for the terminally ill. Palliat Med. 2000;14(5):375-385.
FREE FULL TEXT
60. Ringdal GI, Jordhøy MS, Kaasa S. Family satisfaction with end-of life care for cancer patients in a cluster randomized trial. J Pain Symptom Manage. 2002;24(1):53-63.
PUBMED
61. Jordhøy MS, Fayers P, Saltnes T. Ahlner- Elmqvist M, Jannert M, Kaasa S. A palliative-care intervention and death at home: a cluster randomised trial. Lancet. 2000;356(9233):888-893.
PUBMED
62. Dibble SL, Padilla GV, Dodd MJ, Miaskowski C. Gender differences in the dimensions of quality of life. Oncol Nurs Forum. 1998;25(3):577-583.
PUBMED
63. Aaronson NK, Ahmedzai S, Bergman B, et al. The European Organisation for Research and Treatment of Cancer QLQ-C30. J Natl Cancer Inst. 1993;85(5):365-376.
FREE FULL TEXT
64. Ware JE Jr, Sherbourne CD. The MOS 36-item short-form health survey (SF-36), I. Med Care. 1992;30(6):473-483.
PUBMED
65. Schipper H, Clinch J, McMurray A, Levitt M. Measuring the quality of life of cancer patients: the Functional Living Index-Cancer. J Clin Oncol. 1984;2(5):472-483.
ABSTRACT
66. Bergner M, Bobbitt RA, Carter WB, Gilson BS. The Sickness Impact Profile. Med Care. 1981;19(8):787-805.
PUBMED
67. Ware JE Jr. Scales for measuring general health perceptions. Health Serv Res. 1976;11(4):396-415.
PUBMED
68. McMillan SC, Weitzner M. Quality of life in cancer patients. Cancer Pract. 1998;6(5):282-288.
PUBMED
69. Spitzer WO, Dobson AJ, Hall J, et al. Measuring the quality of life of cancer patients. J Chronic Dis. 1981;34(12):585-597.
PUBMED
70. Pfeiffer E.. A short portable mental status questionnaire for the assessment of organic brain deficit in elderly patients. J Am Geriatr Soc. 1975;23(10):433-441.
PUBMED
71. Kane RL, Klein SJ, Bernstein L, Rothenberg R, Wales J. Hospice role in alleviating the emotional stress of terminal patients and their families. Med Care. 1985;23(3):189-197.
PUBMED
72. Portenoy RK, Thaler HT, Kornblith AB, et al. The Memorial Symptom Assessment Scale. Eur J Cancer. 1994;30A(9):1326-1336.
PUBMED
73. Zimmer JG, Groth-Juncker A, McCusker J. Effects of a physician-led home care team on terminal care. J Am Geriatr Soc. 1984;32(4):288-292.
PUBMED
74. Torgerson DJ. Contamination in trials. BMJ. 2001;322(7282):355-357.
FREE FULL TEXT
75. Christakis NA, Escarce JJ. Survival of Medicare patients after enrollment in hospice programs. N Engl J Med. 1996;335(3):172-178.
PUBMED
76. Costantini M, Toscani F, Gallucci M, et al.; ItalianCooperative Research Group on Palliative Medicine. Terminal cancer patients and timing of referral to palliative care. J Pain Symptom Manage. 1999;18(4):243-252.
PUBMED
77. Jordhøy MS, Kaasa S, Fayers P, Ovreness T, Underland G, Ahlner-Elmqvist M. Challenges in palliative care research. Palliat Med. 1999;13(4):299-310.
FREE FULL TEXT
78. Campbell MK, Grimshaw JM. Cluster randomised trials: time for improvement. BMJ. 1998; 317(7167):1171-1172.
FREE FULL TEXT
79. Simpson JM, Klar N, Donnor A. Accounting for cluster randomization. Am J Public Health. 1995;85(10):1378-1383.
FREE FULL TEXT
80. World Health Organization. WHOdefinition of palliative care. http://www.who.int/cancer/palliative/definition/en. 2002. Accessed September 15, 2007.81. Ferris FD, Balfour HM, Bowen K, et al. A Model to Guide Hospice Palliative Care: Based on National Principles and Norms of Practice. Ottawa, ON: Canadian Hospice Palliative Care Association; 2002.82. Cella DF, Tulsky DS, Gray G, et al. The Functional Assessment of Cancer Therapy scale: development and validation of the general measure. J Clin Oncol. 1993;11(3):570-579.
FREE FULL TEXT
83. Ware JE, Snow KK, Kosinski M, Gandek B. SF-36 Health Survey Manual and Interpretation Guide. Boston, MA: New England Medical Center; 1993.84. Heyland DK, Dodek P, Rocker G, et al. What matters most in end-of-life care. CMAJ. 2006;174(5):627-633.
FREE FULL TEXT
85. Chochinov HM, Hack T, McClement S, Kristjanson L, Harlos M. Dignity in the terminally ill. Soc SciMed. 2002;54(3):433-443.
86. Steinhauser KE, Christakis NA, Clipp EC, McNeilly M, McIntyre L, Tulsky JA. Factors considered important at the end of life by patients, family, physicians, and other care providers. JAMA. 2000;284(19):2476-2482.
FREE FULL TEXT
87. Groenvold M, Petersen MA, Aaronson NK, et al. The development of the EORTC QLQ-C15-PAL. Eur J Cancer. 2006;42(1):55-64.
PUBMED
88. Cohen SR, Mount BM, Strobel MG, Bui F. The McGill Quality of Life Questionnaire. Palliat Med. 1995;9(3):207-219.
FREE FULL TEXT
89. Steinhauser KE, Clipp EC, Bosworth HB, et al. Measuring quality of life at the end of life. Palliat Support Care. 2004;2(1):3-14.
PUBMED
90. Kaasa S, Loge JH. Quality of life in palliative care. Palliat Med. 2003;17(1):11-20.
FREE FULL TEXT
91. Lynn J.. Measuring quality of care at the end of life. J Am Geriatr Soc. 1997;45(4):526-527.
PUBMED
92. Morrison RS, Siu AL, Leipzig RM, Cassel CK, Meier DE. The hard task of improving the quality of care at the end of life. Arch Intern Med. 2000;160(6):743-747.
FREE FULL TEXT
93. Aspinal F, Addington-Hall J, Hughes R, Higginson IJ. Using satisfaction to measure the quality of palliative care. J Adv Nurs. 2003;42(4):324-339.
PUBMED
94. Wilkinson EK, Salisbury C, Bosanquet N, et al. Patient and carer preference for, and satisfaction with, specialist models of palliative care. Palliat Med. 1999;13(3):197-216.
FREE FULL TEXT
95. Strasser S, Schweikhart S, Welch GE, Burge JC. Satisfaction with medical care. J Health Care Mark. 1995;15(3):34-44.
PUBMED
96. Emanuel EJ, Emanuel LL. The economics of dying. N Engl J Med. 1994;330(8):540-544.
PUBMED
97. Bryce CL, Loewenstein G, Arnold RM, Schooler J, Wax RS, Angus DC. Quality of death: assessing the importance placed on end-of-life treatment in the intensivecare unit. Med Care. 2004;42(5):423-431.
PUBMED
98. Boni-Saenz AA, Dranove D, Emanuel LL, Lo Sasso AT. The price of palliative care. Clin Geriatr Med. 2005;21(1):147-163.
PUBMED
99. Schulz R, Beach SR. Caregiving as a risk factor for mortality. JAMA. 1999;282(23):2215-2219.
FREE FULL TEXT
100. Pinquart M, Sorensen S. Differences between caregivers and noncaregivers in psychological health and physical health. Psychol Aging. 2003;18(2):250-267.
PUBMED
101. Lorenz KA, Lynn J, Dy SM, et al. Evidence for improving palliative care at the end of life. Ann Intern Med. 2008;148(2):147-159.
FREE FULL TEXT
102. Temel JS, Jackson VA, Billings JA, et al. Phase II study: integrated palliative care in newly diagnosed advanced non-small-cell lung cancer patients. J Clin Oncol. 2007;25(17):2377-2382.
FREE FULL TEXT
103. Meyers FJ, Linder J, Beckett L, Christensen S, Blais J, Gandara DR. Simultaneous care: a model approach to the perceived conflict between investigational therapy and palliative care. J Pain Symptom Manage. 2004;28(6):548-556.
PUBMED
ARTICLE EN RAPPORT
Cette semaine dans le JAMA français
JAMA. 2008;299:1639.
Texte Complet
|