 |
 |

Hormone de croissance chez les patients ayant une infection par le VIH et une obésité abdominaleUn essai randomisé et comparatif
Janet Lo, MD, MMSc;
Sung Min You, BA;
Bridget Canavan, MD;
James Liebau, ANP;
Greg Beltrani, BA;
Polyxeni Koutkia, MD;
Linda Hemphill, MD;
Hang Lee, PhD;
Steven Grinspoon, MD
JAMA. 2008;300(5):509-519
RÉSUMÉ
 |  |
Contexte Les traitements antirétroviraux peuvent être associés à une adiposité viscérale et des complications métaboliques, un risque cardio-vasculaire croissant. La réduction de la sécrétion d'hormone de croissance (GH) peut être un facteur contributif.
Objectif Etudier les effets de l'administration à faible dose physiologique de GH sur la composition corporelle, le glucose, et les paramètres cardio-vasculaires chez des patients infectés par le virus de l’immunodéficience humaine (VIH) et atteint d’une accumulation abdominale des graisses avec insuffisance relative de GH.
Schéma, environnement et patients Etude randomisée, en double insu, contre placebo sur 56 patients infectés par le VIH, une accumulation abdominale des graisses, et une diminution de la sécrétion de GH (GH maximal <7.5 ng/ml) conduite dans un centre médical universitaire des USA entre novembre 2003 et octobre 2007.
Intervention Les patients étaient aléatoirement assignés à la GH sous-cutanée ou à un placebo apparié titré au quartile supérieur de la dose normale du facteur de croissance insulin-like 1 (IGF-1) pendant 18 mois. La dose initiale était de 2 µg/kg/jour et montait jusqu'à une dose maximum de 6 µg/kg/jour (dose moyenne, 0.33 mg/jour).
Principaux critères de jugement Modification de la composition corporelle évaluée par scanner et absorptiométrie à rayons X à double énergie. Les résultats secondaires incluaient la glycémie, l'IGF-1, la pression artérielle (PA), et les lipides. L'effet du traitement était la variation des modifications dans les groupes GH et placebo, à l’aide de toutes les données disponibles.
Résultats Cinquante-cinq patients (26 avec GH et 29 avec placebo) ont été inclus dans les analyses de sécurité et 52 patients (25 avec GH et 27 avec placebo) ont été inclus dans les analyses d'efficacité. La zone de tissu adipeux viscéral (effet thérapeutique [dernière valeur enregistrée incluse dans l’analyse {n=56}, –19 cm2; intervalle de confiance à 95% {IC}, –37 à –0.3 cm2], –19 cm2 ; IC 95%, –38 à –0.5 cm2 ; P=0.049) ; graisse tronculaire (–0.8 kg ; IC 95%, –1.5 à –0.04 kg ; P=0.04) ; BP diastolique (–7 mm Hg; IC 95%, –11 à –2 mm Hg; P=0.006) ; et triglycérides (–7 mg/dl, P=0.002) se sont améliorés mais les taux à deux heures de la glycémie au test de tolérance du glucose ont augmenté dans le groupe GH par rapport au groupe placebo (effet thérapeutique, 22 mg/dl ; IC 95%, 6-37 mg/dl ; P=0.009). Les taux IGF-1 ont augmenté (effet thérapeutique, 129 ng/ml ; IC 95%, 95-164 ng/ml ; P<0.001). Les événements défavorables n'ont pas augmenté avec la GH par rapport au placebo (23% ; IC 95%, 9%-44% contre 28% ; IC 95%, 13%-47% ; P=0.70).
Conclusions Dans l’accumulation de graisses abdominales associée au VIH et l’insuffisance relative de GH, de faibles doses de GH durant 18 mois ont permis une diminution significative de la graisse viscérale et de l’obésité tronculaire, des triglycérides, et de la PA diastolique, mais les taux à deux heures de la glycémie au test de tolérance au glucose ont augmenté.
Trial Registration clinicaltrials.gov Identifier: NCT00100698
Les patients présentant une infection par le virus de l’immunodéficience humaine (VIH) traités par antirétroviraux développent fréquemment des modifications de la composition corporelle comprenant une obésité abdominale et des complications métaboliques comme des dyslipidémies et une résistance à l’insuline, prédisposant cette population de patients à une augmentation du risque cardio-vasculaire.1 La sécrétion de l’hormone de croissance (GH) est réduite chez les patients infectés par le VIH et une accumulation de graisse abdominale, 2,3 une insuffisance relative de GH (GHD), basée sur la réponse à l'hormone de stimulation de la GH (GHRH) avec test à l’arginine, est observée chez approximativement un tiers de ces patients. 3 Une GHD relative est commune chez les patients infectés par le VIH ayant une lipodystrophie, et il est le plus souvent observé chez les hommes infectés par le VIH ayant une accumulation de graisse abdominale. La proportion de patients ayant une infection par le VIH et un GHD relatif s'est avérée être de 37% à 39% chez les hommes et 16% chez les femmes ayant une accumulation de graisse abdominale, sur la base des réponses à la GHRH avec un test à l’arginine de 7.5 ng/ml dans les études antérieures.3,4
Chez les patients non infectés par le VIH mais ayant un GHD, la masse graisseuse, en particulier la graisse viscérale, 5,6 les taux de lipides, 7,8 et le taux de maladie cardio-vasculaire 9 sont augmentés, l’administration de GH améliore de manière significative la composition corporelle avec une réduction de la graisse viscérale, 6,10 le taux de cholestérol 6,11-13 and et les marqueurs inflammatoires. 13 Les patients ayant un GHD ont souvent une résistance à l’insuline, 14,15 et un traitement à long terme par la GH peut potentiellement améliorer l'homéostasie du glucose en dépit d'une détérioration initiale de la sensibilité à l’insuline.16-18
Chez les patients infectés par le VIH et ayant une obésité abdominale, un traitement avec des doses supra-physiologiques de GH (2-4 mg/jour) pendant 12 semaines a diminué la graisse viscérale tout en étant associé à des événements défavorables significatifs de liés à la GH, dont des œdèmes périphériques, des arthralgies, et une augmentation de la glycémie.19,20 Dans une petite étude pilote en ouvert chez des hommes infectés par le VIH et ayant une accumulation de graisses, 21 des doses inférieures de GH (1 mg) pendant 6 mois ont diminué la graisse tronculaire. Dans notre étude, nous avons identifié des patients infectés par le VIH, ayant une accumulation de graisse abdominale, et une réduction relative de sécrétion de la GH, un groupe susceptible de tirer bénéfice de l'administration de GH. Nous avons déterminé si une faible dose physiologique de GH améliorerait la composition corporelle, les lipides, et d'autres paramètres métaboliques et serait bien tolérée dans ce groupe dans une étude randomisée, en double insu, contre placebo de dix-huit mois.
METHODES
Participants
Des patients infectés par le VIH et ayant des signes de lipodystrophie ont été inclus dans l'étude, conduite au Massachusetts General Hospital grâce à de la publicité au sein de la communauté, des groupes de soutien et de défense du VIH et, des références de spécialistes des maladies infectieuses ou de médecin de soins primaires, entre novembre 2003 et mars 2006. Le dernier patient a fini la visite de dix-huit mois en octobre 2007. Les critères d'inclusion incluaient (1) âge allant de 18 à 60 ans ; (2) infection par le VIH précédemment diagnostiquée ; (3) protocole antirétroviral stable pendant au moins 12 semaines avant l’inclusion ; (4) rapport taille-hanche supérieur à 0.9 pour les hommes et 0.85 pour les femmes ; (5) preuve soit d’une augmentation du périmètre abdominal, de perte relative de graisses dans les extrémités, soit de perte relative de graisses au niveau du visage s’étant produit dans le cadre d’un traitement antirétroviral ; et (6) un GHD relatif, défini par une réponse maximale stimulée de la GH par la GHRH avec test à l’arginine inférieur à 7.5 ng/ml (pour convertir en microgrammes par litre, multiplier par 1.0).3 Les critères d'exclusion incluaient (1) l'utilisation de GH, d’antidiabétiques, d'acétate de megestérol, ou d'autres agents anaboliques dans les 3 mois de l’inclusion ; (2) le diabète ; (3) un taux d'hémoglobine inférieur à 9.0 g/dl (pour convertir en grammes par litre, multiplier par 10.0), un taux de créatinine supérieur à 1.4 mg/dl (pour convertir en micromoles par litre, multiplier par 88.4), ou un taux spécifique de l’antigène prostatique supérieur à 4 ng/ml (pour convertir en microgrammes par litre, multiplier par 1.0) ; (4) une bêta gonadotropine chorionique humaine positive (beta HCG) ; (6) syndrome du canal carpien ; et (7) une affection maligne ou des antécédents de maladie maligne. Les participants ayant des antécédents de maladie pituitaire ou de traitement radioactif étaient exclus. Les hommes ayant un hypogonadisme documenté ou sous traitement de réplétion par testostérone pouvaient participer et 29% des participants étaient des hommes sous testostérone à l’état initial. Les taux de testostérone n'étaient pas disponibles pour cette étude.
La race et l'appartenance ethnique étaient déterminées par les participants à l’aide de catégories fournies par les investigateurs. Ces données ont été recueillies parce qu’il existe selon les différences raciales des variations dans les mesures des résultats, incluant la graisse tissulaire viscérale (VAT).22 Un sous-ensemble de patients représentés dans les données de dépistage a été examiné dans une étude antérieure caractérisant le rôle du sexe et de la race dans la dynamique de la GH chez les patients infectés par le VIH.4 L'étude était approuvée et revue annuellement par le comité d'examen institutionnel du Massachusetts General Hospital. Les participants ont fourni un consentement éclairé écrit et donné leur permission pour que les résultats de l'étude soient publiés.
Procédures de l’étude
Après un jeune nocturne de 12 heures, la réponse de la GH à GHRH avec stimulation par l’arginine, les taux de glucose et de créatinine, une numération formule sanguine, l’antigène spécifique de la prostate, un test urinaire de grossesse, et les mesures anthropométriques étaient évaluées lors du dépistage. Les antécédents médicaux et antirétroviraux étaient recueillis. Les participants éligibles revenaient pour une visite à l’état initial, suivi de visites de tolérance à 2 semaines et aux mois 1, 3, 9, et 15, qui se composaient d’une évaluation de la glycémie à jeun, du facteur de croissance insulin-like 1 (IGF-1), des événements intermédiaires, d’un examen clinique, et d’une mesure urinaire des bêta-HCG. Des visites d'évaluation intermédiaires étaient effectuées aux mois 6, 12, et 18.
Pendant la visite et les visites allant de l’état initial aux mois 6, 12, et 18, les données suivantes ont été enregistrées après un jeun nocturne de 12 heures : (1) mesures anthropométriques ; (2) 75 résultats d’un test oral de tolérance à 75 g de glucose ; (3) taux de glucose, d'insuline, d'IGF-1, d'adiponectine, et d'hémoglobine A1c ; profil des lipides (cholestérol total, cholestérol des lipoprotéines de haute densité [HDL], et triglycérides) ; nombre de CD4 ; et charge virale VIH ; (4) scanner abdominal simple épaisseur; (5) absorptiométrie à rayons X à double énergie du corps entier ; (6) étude des résultats de la Medical Outcomes Study VIH Health Survey (MOS-VIH) ; (7) doppler de la carotide ; et (8) bêta-HCG urinaire.
Une phase de dix-huit mois de prolongation pour déterminer les effets du retrait de la GH et pour proposer le traitement aux patients sous placebo a suivi la phase de randomisation. L'analyse primaire a été exécutée après la période de dix-huit mois initiale. Les données de la phase de prolongation seront disponibles en juin 2009.
Intervention, randomisation, et mise en aveugle
Les analyses initiales terminées, les participants étaient aléatoirement assignés pour recevoir les injections sous-cutanées quotidiennes de GH humaine recombinante (Serostim ; EMD Serono, Rockland, Massachusetts, filiale de Merck KGaA, Darmstadt, Allemagne) ou un placebo identique. Le placebo était fabriqué par EMD Serono. La randomisation était exécutée par la pharmacie du Massachusetts General Hospital à l’aide d’un algorithme avec permutation de bloc, les tailles de bloc variant aléatoirement de 4 à 8 et stratifiée selon le sexe. Les participants, les investigateurs, et le personnel de l’étude étaient en aveugle par rapport à la randomisation.
La dose de début du médicament à l’étude était de 2 µg/kg/jour et titrée jusqu'à une dose maximale de 6 µg/kg/jour. Les augmentations de dose étaient faites à chaque visite suivant la dose initiale, sur la base d’un algorithme pour placer l’IGF-1 dans le quartile supérieur de la gamme normale ajustée sur l'âge, sans aller au delà de la limite supérieure de la normale. Cet algorithme avait été choisi pour maximiser le dosage de la GH tout en la gardant dans une marge physiologique. Les investigateurs de l’étude étaient en aveugle par rapport aux résultats de l’IGF-1 et des recommandations de dose étaient émises par un médecin indépendant. Pour maintenir l’insu de l'étude, le médecin suivant les taux d’IGF-1 recommandait un changement parallèle d'un patient sous placebo aléatoirement choisi pour chaque changement recommandé d'un patient sous GH.
Les participants recevaient des conseils d'autogestion du médicament à l’étude des investigateurs de l’étude. L'administration du traitement à l’étude était surveillée à la visite initiale pour s’assurer que la technique était appropriée. L'adhérence du patient était évaluée les injections notées dans un journal et mesurée tous les 3 mois.
Sécurité d’emploi
Les participants ayant une glycémie à jeun supérieure à 200 mg/dl (pour convertir en millimoles par litre, multiplier par 0.0555) durant leur participation interrompaient l’étude et les participants ayant une glycémie à jeun supérieure à 150 mg/dl avaient une diminution de la dose de 25%. Un participant du groupe placebo ayant une glycémie à jeun supérieure à 200 mg/dl a été sorti à la visite des deux semaines. En outre, 1 participant du groupe placebo et 1 participant du groupe GH ont subi une réduction de dose de 25% en raison d’une glycémie à jeun supérieure à 150 mg/dl. Un conseil de surveillance des données et de la tolérance (DSMB) se rencontrait tous les 3 mois pour évaluer les événements défavorables de l'étude. Le DSMB n'a pas examiné les données d'efficacité. Tous les événements défavorables ont été rapportés au DSMB et au comité d'examen institutionnel selon les régulations des institutions.
Evaluation de la GH
Un seuil de réponse maximale de la GH à la GHRH avec test à l'arginine inférieur à 7.5 ng/ml a été employé pour définir un GHD relatif parce qu'il réalisait une discrimination optimale entre les patients infectés par le VIH ayant une lipodystrophie et accumulation de graisse abdominale et les témoins sains ayant un indice de masse corporelle similaire (IMC, calculées comme le poids en kilogrammes divisé par la taille en mètres carrés) dans une étude antérieure.3
Critères de jugement
Analyse de la composition corporelle. La VAT abdominale et les zones sous-cutanées de tissu adipeux (SAT) ont été évalués par une coupe transversale par scanner abdominal avec pendant tel que précédemment rapporté.23 Une absorptiométrie à rayons X à double énergie a été faite comme précédemment décrite. 23
Doppler carotidien. L'épaisseur intima-média de la carotide (IMT) a été évaluée et analysé tous les 6 mois selon un protocole standard comme précédemment décrite. 24
Analyses biochimiques. La concentration en hormone de croissance a été mesurée par RIA (Corning Nichols, San Juan Capistrano, Californie). Avant novembre 2005, l’IGF-1 était mesuré par un test immunologique de chimioluminescence (Nichols Institute, San Clemente, Californie). En raison de la conversion du test à l’échelle de l’hôpital, l’IGF-1 a été mesurée par une analyse immunométrique de chimioluminescence (DPC, Los Angeles, Californie) après novembre 2005. Une contre-vérification interne a démontré une étroite corrélation entre les analyses (R2=0.94). Les taux d'insuline sérique ont été mesurés par RIA (DPC). L’adiponectine a été mesurée par RIA (Linco Research, St Charles, Missouri). Le nombre de CD4 a été évalué en employant un flux cytométrique (Becton Dickinson Immunocytochemistry Systems, San Jose, Californie) et l'évaluation de la charge virale VIH a été conduite en employant un test AMPLICOR VIH-1 (Roche Diagnostics, Indianapolis, Indiana), avec une limite de détection inférieure à 400 copies/ml. Les lipides, l'hémoglobine A1c, et les glycémies ont été mesurées en employant des techniques standard au Massachusetts General Hospital.
Qualité de vie. La qualité de vie était évaluée par le MOS-VIH Health Questionnaire, où les scores vont de 0 à 100, un nombre plus élevé indiquant une meilleure qualité de vie.25,26
Analyse statistique
Le critère principal d’évaluation de notre étude était la variation de la composition corporelle, mesurée par la modification de la graisse viscérale (VAT) et secondairement par la modification de la distribution des graisses (tronculaires versus graisse des extrémités). La dimension de l'échantillon a été calculée par le rapport graisse tronculaire/graisses des extrémités en raison de la disponibilité de données publiées pour les faibles doses de GH durant 18 mois chez des patients ayant un GHD13 et du manque de données sur la VAT avec une GH physiologique à long terme chez les patients infectés par le VIH. Pour détecter une différence pré-spécifiée de 0.026 de la variation au cours des 18 mois du rapport graisses tronculaire-graisses des extrémités inférieures entre le groupe GH versus le groupe placebo avec un  bilatéral =0.05 et une puissance de 90%, une taille d'échantillon de 45 patients était nécessaire. Une variation graisse tronculaire-graisses des extrémités de 0.026 représentait approximativement 50% de la variation observée dans une étude antérieure à long terme avec une faible dose de GH chez des patients non infectés par le VIH.13 Un taux de sortie de 20% à 25% était prévu et 56 patients ont été inclus. bilatéral =0.05 et une puissance de 90%, une taille d'échantillon de 45 patients était nécessaire. Une variation graisse tronculaire-graisses des extrémités de 0.026 représentait approximativement 50% de la variation observée dans une étude antérieure à long terme avec une faible dose de GH chez des patients non infectés par le VIH.13 Un taux de sortie de 20% à 25% était prévu et 56 patients ont été inclus.
La sécurité d’emploi et les analyses primaires d'efficacité ont été exécutées en employant toutes les données disponibles, y compris les données partielles disponibles chez les patients ayant discontinué l'étude. La population de la tolérance pour lesquels la tolérance, les IGF-1, et la glycémie étaient évalués a inclus tous les participants (n=55) ayant reçu au moins 1 dose du traitement à l’étude. Pour l'efficacité, dont la VAT et les critères secondaires d'extrémité, la population (n=52) a inclus tous les participants ayant eu au moins 1 visite à 6 mois, première visite intérimaire pour évaluer l'efficacité. La population per-protocole était composée de tous les participants ayant terminé le protocole (n=48). Les « completers » et les « non completers » étaient semblable à l’état initial pour les caractéres démographiques, la composition corporelle, l'IGF-1, les triglycérides, et les niveaux de glycémie à deux heures. Les taux d’événement défavorable, d’événements défavorables graves, et d’événement défavorable liés à la GH n'ont pas différé entre les groupes (P<0.40 pour chaque comparaison).
Les caractéristiques à l’état basal pour les variables continues sont présentées en employant les moyennes et les intervalles de confiance à 95% (IC) sauf indication contraire, et la comparaison entre les 2 groupes à la ligne de base a été effectuée à l’aide d’un test t pour les variables continues et d’un test du chi 2 pour les variables catégorielles. L'effet thérapeutique (différence nette pour la variation entre la GH et le placebo, et les IC 95% [calculés en employant une erreur type modélisée de l'évaluation ajustée de l’effet thérapeutique]) ont été déterminés en employant une analyse des effets mixtes des mesures répétées de covariance, avec ajustement sur l'âge, le sexe, la race, le dosage du médicament à l'étude, aussi bien que sur la testostérone à la ligne de base, l'inhibiteur de protéase, et l'utilisation d'inhibiteurs nucléosidiques de la transcriptase inverse. Les données initiales sur l'utilisation d'antihypertenseurs et d’hypolipémiants aussi bien que sur le tabagisme ont été incluses en tant que covariables additionnelles dans l'analyse de la variation de l’IMT de la carotide. L'utilisation d'antihypertenseurs a été incluse comme covariable dans l'analyse de la modification de la pression artérielle (PA), et l'utilisation d’hypolipémiants a été incluse comme covariable dans l'analyse de la variation des critères lipidiques. L'effet thérapeutique a été évalué par la signification statistique de l'effet d'interaction groupe x temps (GH versus placebo). Pour chaque participant, les données disponibles des mois 6, 12, et 18 ont été regroupées et comparées aux valeurs initiales pour obtenir une variation globale tout au long de la durée du traitement. Cette approche a été choisie par rapport à une analyse de pente car les données ne montraient pas une dépendance linéaire au temps et les changements se produisant à 6 mois se sont généralement maintenus tout au long de la durée de l'étude. Pour adapter le modèle des effets mixtes aléatoires avec la structure échangeable de corrélation pour les mesures répétées, nous a employé la procédure mixte SAS proc (SAS Institute Inc, Cary, Caroline du Nord).
Des analyses secondaires employant également l'analyse des effets mixtes pour les mesures répétées de covariance ont été faites dans la population per-protocole (n=48) et également dans un sous-ensemble limité aux hommes seulement (n=49). En outre, un modèle des mesures répétées dans lequel les données absentes étaient imputées à l’aide d’une approche dernière observation rapportée incluse dans l’analyse a été employée pour le critère primaire, la VAT.
Aucun ajustement n'a été fait pour les comparaisons multiples des critères secondaires dans l'analyse primaire. Dans les analyses secondaires, une correction de Bonferroni a été appliquée pour expliquer les critères multiples dans chaque catégorie (par exemple, composition corporelle, lipides, paramètres biochimiques et cardio-vasculaires). Les résultats n'ont pas changé pour la majorité des critères secondaires statistiquement significatifs (rapport graisse tronculaire-extrémités inférieures, taux des triglycérides, IGF-1, glycémie à 2 heures, PA diastolique) en employant cette correction.
Des valeurs extrêmes d’augmentation des triglycérides ont été observées chez 3 patients et un test de la somme des rangs de Wilcoxon a donc été employé pour les données regroupées aux mois 6, 12, et 18 à la suite de l'absence de différence statistique à l’état initial.
Dans l'analyse de population et dans l’analyse initiale de dépistage, la corrélation de la réponse maximale de la GH à GHRH avec test à l’arginine avec des paramètres métaboliques a été évaluée en employant un test 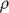 de Spearman, car les taux maximaux de GH n'étaient pas été distribués de façon harmonieuse. de Spearman, car les taux maximaux de GH n'étaient pas été distribués de façon harmonieuse.
Toutes les valeurs rapportées de P étaient bilatérales et P<0.05 a été considérée comme statistiquement significative. Les analyses statistiques ont été exécutées en employant SAS version 9 (SAS Institute Inc) et SAS JMP Statistics version 5.1.
RESULTATS
Données du dépistage
Cent quatre-vingt-douze patients infectés par le VIH ont été interviewés pour cette étude entre novembre 2003 et mars 2006 (Figure 1). Les données étaient disponibles pour 191 patients du test de stimulation de la GH. L'âge moyen de la population était de 45 ans (IC 95%, 44-46 ans). La population avait un IMC moyen de 26.6 (IC 95%, 25.9-27.2), et les participants étaient blancs à 74% et des hommes à 84%.
|
|

|
Figure 1. Study Participant Enrollment and Discontinuation
|
|
|
La réponse moyenne du pic de GH à la GHRH avec test à l’arginine était de 21.2 ng/ml (IC 95%, 17.5-24.9 ng/ml). La réponse du pic de GH était corrélée significativement et inversement avec les triglycérides (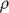 =–0.37, P<0.001), le cholestérol total ( =–0.37, P<0.001), le cholestérol total (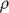 =–0.22, P=0.004), la PA systolique ( =–0.22, P=0.004), la PA systolique (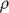 =–0.23, P=0.002), et la PA diastolique ( =–0.23, P=0.002), et la PA diastolique (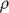 =–0.17, P=0.02). En contrôlant sur l'âge, le sexe, l’IMC, l'inhibiteur de protéase et l'usage d’hypolipémiants, la réponse maximale de la GH demeurait un facteur prédictif indépendant de concentration des triglycérides à jeun ( =–0.17, P=0.02). En contrôlant sur l'âge, le sexe, l’IMC, l'inhibiteur de protéase et l'usage d’hypolipémiants, la réponse maximale de la GH demeurait un facteur prédictif indépendant de concentration des triglycérides à jeun (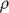 =–1.12 mg/dl [pour convertir en millimoles par litre, multiplier par 0.0113] changements des taux de triglycérides par ng/ml [1 µg/L] par modifications du pic de GH, P=.03). Un total de 33% de participants interviewés a eu une réponse du pic de GH à la GHRH plus arginine inférieur à 7.5 ng/ml. =–1.12 mg/dl [pour convertir en millimoles par litre, multiplier par 0.0113] changements des taux de triglycérides par ng/ml [1 µg/L] par modifications du pic de GH, P=.03). Un total de 33% de participants interviewés a eu une réponse du pic de GH à la GHRH plus arginine inférieur à 7.5 ng/ml.
Résultat de l’étude interventionnelle
Cinquante-six patients ont été inclus dans l'étude. Les caractéristiques initiales de la population de l’étude étaient semblables entre les groupes (Tableau 1). Vingt-sept participants ont été assignés à la GH, dont 21 (78%) ont terminé l'étude ; et 29 participants ont été assignés au placebo, dont 27 (93%) ont terminé l'étude (Figure 1). Les taux de discontinuation n'ont pas été statistiquement différents entre les groupes (P=0.10). On n'a pas observé de changements majeurs de la classe des antirétroviraux, des antihypertenseurs et des hypolipémiants entre les groupes pendant l'étude. L'utilisation initiale des antirétroviraux dans chaque classe principale et les différents traitements n'étaient pas essentiellement différents entre les groupes. Les médicaments utilisés le plus souvent (population de l’étude >15%), dans les groupes GH et placebo ont inclus la lamivudine, 71% (59% et 83%, respectivement) ; le ténofovir, 52% (56% et 48%, respectivement) ; le ritonavir, 38% (37% et 38%, respectivement) ; la zidovudine, 34% (30% et 38%, respectivement) ; l’éfavirenz, 29% (26% et 31%, respectivement) ; l’abacavir, 20% (30% et 10%, respectivement) ; la névirapine, 20% (22% et 17%, respectivement) ; l’atazanavir, 18% (19% et 17%, respectivement) ; et le lopinavir, 18% (15% et 21%, respectivement). Spécifiquement, il n'y a eu aucune différence statistiquement significative d'utilisation de la stavudine (15% dans le groupe GH contre 17% dans le groupe placebo, P=0.80).
|
|

|
|
Tableau 1. Caractéristiques initiales des participants à l’étude à la randomisation a
|
|
|
Dosage
Pendant l'étude de dix-huit mois, les doses moyennes de GH ont été de 3.7 µg/kg/jour (IC95%, 3.3-4.1 µg/kg/jour ; dose moyenne, 0.33 mg/jour ; IC 95%, 0.29-0.38 mg/jour) et la dose moyenne de placebo a été de 3.8 µg/kg/jour (IC95%, 3.5 - 4.1 µg/kg/jour ; dose moyenne, 0.33 mg/jour ; IC 95%, 0.30-0.36 mg/jour) (Figure 2). Des ajustements de doses parallèles pour le placebo ont été faits et le dosage était semblable entre les groupes. On a également observé des dosages semblables dans la population per-protocole. Les journaux d'observance ont été retournés par 79% des patients dans le groupe placebo comparés à 74% des patients dans le groupe GH (P=0.64). L'observance, évaluée par l'intermédiaire d’un journal rempli par le patient, a été de 94% dans le groupe GH comparée à 95% dans le groupe placebo, dans les journaux retournés.
|
|

|
Figure 2. Dosage de l’hormone de croissance (GH) vs placebo titré sur 18 mois
Aucune signification statistique trouvée pour chaque point. Les barres d'erreur indiquent l'erreur type moyenne. Les nombres de patients évalués à 2 semaines étaient 26 pour le GH et 29 pour le placebo.
|
|
|
Composition corporelle et IGF-1
La zone viscérale de tissu adipeux a diminué significativement dans le groupe GH comparé au groupe placebo (effet thérapeutique, –19 cm2; IC 95%, –38 à –0.5 cm2; P=0.049) (Figure 3), ce qui correspond à un pourcentage de variation de la VAT de –8.5% dans le groupe GH et de –1.6% dans le groupe placebo. L’effet taille pour la VAT était semblable dans les analyses secondaires (analyse per-protocole [n=48], –17 cm2; IC 95%, –37 à 3 cm2 ; dernière analyse incluse dans l’étude [n=56], –19 cm2; IC 95%, –37 à –0.3 cm2 ; et analyse en excluant les patientes [n=49], –21 cm2; IC 95%, –41 à –2 cm2). La réduction moyenne de pourcentage de la VAT chez les patients traités par GH a été de –8.5% (erreur type moyenne, 2.7%), tandis que la réduction médiane de –13.4%. La variabilité des réponses est indiquée par les extrêmes interquartiles des réponses de –22.3% à 4.6%.
|
|

|
Figure 3. Effets de l’hormone de croissance (GH) versus le placebo sur le tissu adipeux viscéral et les taux de facteur de croissance Insulin-like 1 sur 18 mois
Pour le tissu adipeux viscéral, P<0.05 pour l'effet sur 18 mois ; et pour les taux de facteur de croissance insulin like 1, P<0.001 pour l'effet sur 18 mois. Les barres d'erreur indiquent l'erreur type moyenne. Les données du facteur de croissance Insulin-like 1 sont présentées pour la population de tolérance, pour toutes les visites, y compris les visites de tolérance. Les nombres de patients évalués à 2 semaines étaient identiques à ceux évalués à 1 mois.
|
|
|
Le rapport des graisses tronculaires-extrémités inférieures (effet thérapeutique, - 0.4 ; IC 95%, - 0.6 à - 0.2 ; P<0.001) et la graisse tronculaire (effet thérapeutique, - 0.8 kg ; IC 95%, - 1.5 à - 0.04 kg ; P=0.04) ont diminué dans le groupe GH par rapport au groupe placebo (Tableau 2). Les SAT de graisses abdominales et la graisses des extrémités n'ont pas changé. La masse maigre a augmenté significativement dans le groupe GH comparé au groupe placebo (effet thérapeutique, 1.3 kg ; IC 95%, 0.2-2.3 kg ; P=0.02).
L’IGF-1 a augmenté avec le traitement par GH comparé au traitement placebo (effet thérapeutique, 129 ng/ml ; IC 95%, 95-164 ng/ml ; P<0.001) (Figure 3 et Tableau 2). On a observé des changements semblables pour IGF-1 dans l'analyse per-protocole. Le changement de la VAT a été corrélé avec la VAT initiale (r= -0.30, P=0.03) et le changement de l’IGF-1 (r= -0.31, P=0.03).
|
|

|
|
Tableau 2. Effects of Growth Hormone vs Placebo on Body Composition, Lipid Profiles, Biochemical Parameters, and Cardiovascular and Immune Functiona
|
|
|
Lipides
Les triglycérides ont diminué (effet thérapeutique, - 7 mg/dl ; P=0.002), tandis que le cholestérol total et le cholestérol des HDL étaient inchangés dans le groupe GH comparé au groupe placebo (Tableau 2).
Glucose, insuline, et adiponectine
La glycémie à 2 heures au test de tolérance au glucose a augmenté dans le groupe GH. Il a été observé des changements semblables dans l'analyse per-protocole. La glycémie à jeun, l'insuline à jeun, l’hémoglobine A1c, et l'adiponectine n'ont pas changé dans le groupe GH comparé au groupe placebo (Tableau 2). Chez les participants du groupe GH, la glycémie à jeun (10 mg/dl ; IC 95%, 2-18 mg/dl contre 5 mg/dl ; IC 95%, 2-8 mg/dl) et à deux heures (32 mg/dl ; IC 95%, 2-62 mg/dl contre 10 mg/dl ; IC 95%, - 9 à 30 mg/dl) ont tendu à plus augmenter chez les participants ayant initialement une anomalie de la glycémie à jeun (n=7) par rapport à ceux n’en ayant pas (n=17), respectivement. On a observé des résultats similaires dans la population per-protocole. En revanche, la variation de l’IGF-1 n'a pas été liée au changement du taux de glycémie à deux heures (r= -0.19, P=0.37). On a observé des résultats similaires dans l'analyse per-protocole (r=-0.18, P=0.44).
Paramètres cardiovasculaires
La PA diastolique (effet thérapeutique, - 7 mm Hg ; IC 95%, - 11 à – 2 mm Hg ; P=0.006) a diminué avec la GH, alors que le changement de PA systolique n'était pas statistiquement différent comparé au placebo (effet thérapeutique, - 6 mm Hg ; IC 95%, - 13 to 1 mm Hg ; P=0.09). L’IMT de la carotide n'a pas changé dans le groupe GH comparé au groupe placebo (effet thérapeutique, - 0.004 mm ; IC 95%, - 0.035 à 0.026 mm ; P=0.78). Le taux de glucose à 2 heures a été significativement associé à l’IMT de la carotide à 18 mois (r=0.38, P=0.009), mais pas à l’état initial (r=0.07, P=0.58).
Paramètres de tolérance et qualité de vie
Initialement, il n'y avait aucun rapport significatif entre le nombre de CD4 et l'IGF-1 (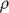 =-0.05, P=0.71), bien qu'il ait y eu une tendance pour le rapport CD4/réponse maximale de la GH à la GHRH plus arginine ( =-0.05, P=0.71), bien qu'il ait y eu une tendance pour le rapport CD4/réponse maximale de la GH à la GHRH plus arginine (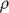 =0.25, P=0.06). On n'a observé aucun effet thérapeutique de la GH sur la charge virale VIH ou le nombre de CD4 (Tableau 2). La modification de qualité de vie, mesurée par le domaine de qualité de vie de l'enquête MOS-VIH, n'a pas différé entre les groupes GH et placebo (Tableau 2). =0.25, P=0.06). On n'a observé aucun effet thérapeutique de la GH sur la charge virale VIH ou le nombre de CD4 (Tableau 2). La modification de qualité de vie, mesurée par le domaine de qualité de vie de l'enquête MOS-VIH, n'a pas différé entre les groupes GH et placebo (Tableau 2).
Effets indésirables
Les événements défavorables n'ont pas significativement augmenté dans le groupe GH comparé au groupe placebo (Tableau 3). Un total de 23% de participants du groupe GH a eu des événements défavorables potentiellement liés à la GH comparés à 28% des participants du groupe placebo. Quatre événements défavorables sérieux se sont produits dans le groupe GH, dont un cancer rectal, une hospitalisation pour confusion et élévation des transaminases (vraisemblablement liés à la progression du VIH), une fracture de hanche et une appendicite exigeant la chirurgie. Aucun de ces événements n'a été considéré comme lié au traitement par la GH. Un événement défavorable sérieux a été noté dans le groupe placebo (cancer anal).
|
|

|
|
Tableau 3. Résumé des événements indésirables
|
|
|
COMMENTAIRE
Dans notre étude, l'administration physiologique de GH a réduit de manière significative la graisse tronculaire et l’obésité viscérale, les triglycérides, et la PA diastolique tout en étant bien tolérée. Cependant, la GH a augmenté le taux à deux heures de glycémie après teste de tolérance chez les patients ayant une accumulation de graisse abdominale associée au VIH et à un GHD relatif au cours d'une période prolongée de traitement de 18 mois.
Les données de dépistage démontrent des corrélations inverses significatives entre la réponse maximale de la GH à la GHRH avec test de stimulation par l’arginine et les paramètres métaboliques importants. Prises ensemble, ces données suggèrent que la réduction de la sécrétion de GH est associée aux anomalies métaboliques chez les patients ayant une infection par le VIH et une accumulation de graisse abdominale.
L'hormone de croissance est une hormone anabolique qui a des effets lipolytiques, augmentant la mobilisation des triacylglycérols des tissus adipeux.27 L'hormone de croissance inhibe la lipoprotéine lipase dans les tissus adipeux, 28,29 réduit la lipogenèse de novo dans le foie, 30 et augmente les taux d'oxydation globaux des graisses, 31 qui peuvent contribuer à ses effets positifs sur les lipides. Compatible avec ces effets physiologiques connus de la GH, nous avons constaté que l'administration de GH chez les patients infectés par le VIH et ayant un GHD relatif (1) diminuait la graisse viscérale abdominale et la graisse tronculaire, (2) augmentait la masse maigre du corps, et (3) diminuait les triglycérides. En outre, le changement de la VAT était corrélé de manière significative avec le changement de l’IGF-1. En revanche, nous avons trouvé une épargne du SAT abdominal et de la graisse des extrémités aux faibles doses employées, importante chez les patients infectés par le VIH qui ont fréquemment une lipoatrophie des graisses sous-cutanées. En effet, nos patients avaient une graisse des extrémités relativement basse à la ligne de base en dépit d’une accumulation centrale marquée. En revanche, des doses plus élevées de GH chez les patients infectés par le VIH ont diminué le SAT et VAT.19 La diminution relative de la VAT obtenue dans notre étude est moindre qu'avec une forte dose de GH, mais plus importante que dans la plupart des études sur l’exercice et les modifications diététiques32 et les stratégies de sensibilisation à l’insuline chez les patients infectés par le VIH. 33,34 On ne sait pas si une amélioration de la sécrétion de la GH avec une réduction en graisse viscérale contribue aux bénéfices métaboliques d’une intervention sur le style de vie et des autres stratégies destinées à réduire la VAT au sein de la population VIH.
Les études précédentes sur la GH chez les patients infectés par le VIH n'ont pas choisi des patients ayant une diminution de la réponse de la GH au test normalisé de stimulation, étaient sensiblement plus courtes en durée, et avec des doses supra-physiologiques de GH, avec pour résultat des niveaux d’IGF-1 multiples supérieurs aux taux normaux.19,20,35 Contrairement aux études antérieures utilisant 2 à 4 mg/jour, nous avons employé une dose physiologique de 0.33 mg/jour. Bien que les études antérieures aient démontré une amélioration plus marquée de VAT que celle de notre étude, les patients ont éprouvé des événements défavorables liées à la GH considérables. Une petite étude préliminaire à dose intermédiaire (1 mg/jour) de GH a diminué l'obésité tronculaire et a été associé à une intolérance passagère au glucose. 21 Dans notre étude, nous avons choisi des patients ayant démontré une diminution de la capacité sécrétrice de la GH à la ligne de base et nous avons trouvé que de faibles doses de GH étaient bien tolérées. Les événements défavorables liés à cette hormone de croissance n'ont pas été augmentés dans le groupe GH comparé au groupe placebo.
Il a été montré que l'hormone de croissance améliore la sensibilité à l’insuline évaluée par un clamp euglycémique hyperinsulinémique chez les hommes négatifs pour le VIH ayant une obésité abdominale après 9 mois de traitement.16 Nous avons trouvé dans notre étude une détérioration de la glycémie à 2 heures après le test de tolérance. Cette observation peut souligner l’augmentation du risque d'administration de GH pour modifier l'homéostasie du glucose chez les patients présentant une accumulation de graisse viscérale associée au VIH et une résistance d'insuline. Bien que la GH exerce en aigu des effets antagonistes de l’insuline dans le foie et en périphérie, il a été postulé qu’un traitement prolongé par GH chez les individus négatifs pour le VIH ayant une obésité abdominale améliore la sensibilité à l’insuline par réduction de la VAT et réduction consécutive des acides gras libres dans la circulation portale.16,17 Dans une étude utilisant la GH à une dose de 3 mg/jour chez des patients infectés par le VIH, 35 l'effet de la GH sur la mise à disposition du glucose sous l’effet de l’insuline s’aggravait le premier mois, puis s’améliorait par rapport aux valeurs initiales à 6 mois. Notre étude a montré une différence cohérente avec le temps et aucun profil de détérioration initiale et d'amélioration ultérieure (données non montrées). Les taux de glucose ont tendu à se détériorer davantage avec le traitement par la GH chez les participants ayant une glycémie à jeun altérée initialement. Aucun rapport n'a été observé entre le changement de l’IGF-1 et le glucose, suggérant que le statut du glucose initial, potentiellement plus que le niveau d’IGF-1 obtenu, détermine la réponse anormale à la GH.
Une autre stratégie pour influencer l'axe de la GH chez les patients infectés par le VIH est l’utilisation de GHRH.23,36,37 Dans une étude récente, 37 la GHRH (1-44) (tésamoréline), a diminué la VAT et amélioré le cholestérol total, le cholestérol des HDL, les triglycérides, et l’adiponectine sans détérioration des taux de glucose. Cependant, la tésamoréline n'est pas encore disponible en clinique. Dans cette étude, la VAT a diminué de 15% durant les 6 mois en réponse à la tésamoréline, alors que la VAT diminuait approximativement de 9% pendant les 18 mois de notre étude. L’IGF-1 moyen a grimpé jusqu'à un degré comparable dans les deux études (109 ng/ml avec la tésamoréline 37 et 109 ng/ml avec des faibles doses de GH). Les mécanismes potentiels pour expliquer le pouvoir relatif de la GHRH comparé à la GH pour réduire la VAT en dépit d'une augmentation semblable de l’IGF-1 demeurent inconnus mais peuvent se rapporter aux effets physiologiques de la GHRH pour augmenter la pulsatilité endogène de la GH, non obtenue avec la GH. En même temps, l'homéostasie du glucose n'a pas changé avec l'analogue de la GHRH mais s’est aggravée avec les faibles doses de GH pour une même augmentation de l’IGF-1. Davantage de recherches sont nécessaires pour étudier ces différences importantes entre ces 2 stratégies destinées à augmenter la GH dans la population VIH.
Dans notre étude, nous avons trouvé une amélioration de la PA diastolique dans le groupe GH, compatible avec les résultats de Johannsson et al16 qui avaient précédemment démontré que la GH améliorait la PA diastolique chez les hommes ayant une obésité abdominale sans VIH. Cependant, la PA diastolique était plus élevée dans le groupe GH que dans le groupe placebo initialement, et une diminution significative du groupe GH peut en partie représenter une régression vers la moyenne.
Les études précédentes chez les patients non infectés par le VIH et ayant un GHD sévère ont montré que une augmentation de l’IMT de la carotide à la ligne de base et une amélioration de l’IMT de la carotide 38-40 sous administration de GH. L’IMT initiale de la carotide n'a pas augmenté chez nos participants comparés aux témoins sains d'âge comparable, et des réductions significatives en réponse à la GH sont ainsi moins probables. Nos données suggèrent également que des taux accrus de glucose résultant de la GH peuvent limiter les effets bénéfiques de la GH sur l’IMT de la carotide dans la population VIH.
Contrairement aux résultats récents de Napolitano et al 41 utilisant une dose beaucoup plus élevée de GH (3.0 mg/jour pendant les 6 premiers mois puis 1.5 mg/jour pendant les 6 mois suivants), nous n'avons pas trouvé d’augmentation du nombre de CD4 sous GH. En outre, nous n'avons pas évalué le volume ou la libération thymique. Le nombre de CD4 était plus haut à la ligne de base dans notre étude que celui trouvé par Napolitano et al. 41 Nous n'avons pas observé de rapport entre le nombre de CD4 initial et l’IGF-1 et, mais il y avait une association significative proche entre la réponse maximale de la GH à la GHRH avec test à l’arginine et le nombre de CD4 initial. D'autres études sur les effets de faibles doses de GH physiologiques sur la dynamique des cellules T sont nécessaires.
Notre étude a certaines limites, dont un effet taille modeste pour critère primaire, la VAT. Cependant, la variation de la VAT que nous avons observée (- 22 cm2 dans le groupe GH, - 19 cm2 effet thérapeutique par rapport au placebo) avec la GH était comparable en grandeur à celle réalisée par d'autres stratégies, y compris la modification du style de vie, pour réduire l'adiposité abdominale chez les patients sans VIH.42-44 En outre, l'effet du traitement observé dans notre étude a représenté les effets originaux d’un dosage véritablement physiologique dans la population VIH. En considérant les stratégies destinées à réduire la graisse viscérale chez les patients présentant une infection par le VIH, la "Food and Drug Administration" (FDA) considère comme significative une réduction de 8% de la graisse viscérale pour un usage médical de la GH.45 Dans notre étude, les réductions moyennes et médianes en graisse viscérale chez les patients traités par GH étaient - 8.5% et - 13.4%, respectivement, et ainsi peuvent être considérées comme étant médicalement appropriées. L'étude ne peut pas être généralisée aux patients présentant une infection par le VIH avec une sécrétion normale de GH, mais un tiers des patients présentant une infection par le VIH et une accumulation de graisse abdominale a une réduction de la sécrétion de GH mesurée par réponse au test de stimulation normalisé.3 En outre, l'approbation de la GH par la FDA chez les patients sans VIH et ayant un GHD est basée sur la réponse au test de stimulation normalisé de la GH, notre paradigme est ainsi approprié pour sélectionner les patients pour une étude à long terme, avec des faibles doses de GH physiologiques. Approximativement 30% des hommes employaient de la testostérone initialement, mais le pourcentage employant de la testostérone n'était pas différent entre les groupes. Nous avons ajusté sur le sexe et l'utilisation de testostérone dans toutes les analyses et les résultats ont été récapitulés dans les analyses secondaires se limitant aux hommes.
En conclusion, les faibles doses physiologiques de GH chez les patients infectés par le VIH, avec une accumulation de graisse abdominale, et une sécrétion réduite de GH ont amélioré la composition corporelle, les triglycérides, et la PA diastolique sans événements défavorables significatifs mais ont aggravé la glycémie à deux heures après test de tolérance. Les données de notre étude randomisée et contre placebo impliquant une longue durée d'observation conduisent à la prudence dans la discussion concernant l'utilisation de la GH dans la population VIH. Les fortes doses sont très efficaces pour réduire la VAT, mais entraînent un IGF-1 supra-physiologique et beaucoup d'événements défavorables liés à la GH. Les faibles doses physiologiques de GH sont bien tolérées et ont comme conséquence une réduction significative mais plus modeste de la VAT, mais sont néanmoins associées à des taux accrus de glucose. Par conséquent, la fenêtre thérapeutique pour obtenir un rapport optimal risque-bénéfice de la GH chez les individus infectés par le VIH, une accumulation de graisse abdominale, et une résistance à l’insuline, peut être très étroite et difficile à réaliser. L'hormone de croissance n'est pas encore approuvée par la FDA dans le traitement de l’accumulation de graisse abdominale chez les patients infectés par le VIH. D'autres stratégies plus efficaces pour augmenter sans risque la GH et réduire la VAT, y compris l'utilisation de GHRH, peuvent être plus salutaires. En outre, les stratégies utilisant le régime, l'exercice, et le changement de style de vie peuvent être plus rentables à la longue que la GH, en particulier chez les patients infectés par le VIH, ayant une adiposité viscérale et une résistance à l’insuline, chez qui les changements de glycémie peuvent être contre-productifs.
Informations sur les auteurs
Correspondance : Steven Grinspoon, MD, Program in Nutritional Metabolism, Massachusetts General Hospital, 55 Fruit St, LON207, Boston, MA 02114 (sgrinspoon{at}partners.org).
Contributions des auteurs: Le Dr Grinspoon a eu un accès complet à toutes les données de l'étude et accepte la responsabilité de l'intégrité des données et de l'exactitude de l'analyse de données.
Conception et schéma de l’étude: Koutkia, Lee, Grinspoon.
Recueil des données: Lo, You, Canavan, Liebau, Beltrani, Koutkia, Hemphill, Grinspoon.
Analyse et interpretation des données: Lo, You, Canavan, Lee, Grinspoon.
Rédaction du manuscrit: Lo, You, Canavan, Koutkia, Lee, Grinspoon.
Revue critique du manuscrit: Lo, You, Canavan, Liebau, Beltrani, Hemphill, Lee, Grinspoon.
Analyse statistique: Lo, You, Canavan, Lee.
Obtention du financement: Grinspoon.
Aide administrative, technique ou matérielle: You, Canavan, Liebau, Beltrani, Koutkia, Hemphill.
Supervision de l’étude: Grinspoon.
Liens financiers: Le Dr Grinspoon rapporte avoir reçu un soutien pour des recherches indépendantes de EMD Serono et a servi également de conseiller à EMD Serono. En outre, le Dr. Grinspoon rapporte avoir servi de conseiller et reçu l'appui pour ses recherches de Thera Technologies. Aucun autre auteur n'a rapporté de liens financiers.
Financement/Soutien: Cette étude a été financée par les bourses R01 DK63639 (Dr. Grinspoon), F32 HL088991 (Dr. Lo), et M01 RR01066-25S1 des instituts nationaux de la santé. EMD Serono a fourni l'hormone de croissance (Serostim) et le placebo mais n'a pas financé de l'étude.
Rôle des sponsors: Les instituts nationaux de la santé ont revu la conception de l'étude et les rapports des progrès annuels, mais n'ont pas participé à la conduite de l'étude, le recueil, la gestion, l'analyse, ou l'interprétation des données, ou la préparation, la revue, ou l'approbation du manuscrit. EMD Serono n'a joué aucun rôle dans la conception, la conduite, l'analyse, ou les décisions de l’étude pour la soumission du manuscrit.
Présentations antérieures: Présenté en partie à la conférence sur les Rétrovirus et les infections opportunistes ; 6 février 2008 ; Boston, Massachusetts ; et à la société endocrinienne ; 17 juin 2008 ; San Francisco, Californie.
Autres contributions: Nous remercions les patients de leur participation et personnel infirmier et de bionutrition du centre de recherches du Massachusetts General Hospital et le Massachusetts Institute of Technology pour les soins consacrés aux patients.
Affiliations des auteurs: Program in Nutritional Metabolism and Neuroendocrine Unit (Drs Lo, Canavan, Koutkia, et Grinspoon, et Ms You, Messrs Liebau et Beltrani), Boston Heart Foundation (Dr Hemphill), et Department of Biostatistics (Dr Lee), Massachusetts General Hospital, Boston.
BIBLIOGRAPHIE
 |  |
1. Friis-Møller N, Sabin CA, Weber R, et al. Combination antiretroviral therapy and the risk of myocardial
infarction. N Engl J Med. 2003;349(21):1993-2003.
PUBMED
2. Rietschel P, Hadigan C, Corcoran C, et al. Assessment of growth hormone dynamics in human immunodeficiency virus-related lipodystrophy. J Clin Endocrinol Metab. 2001;86(2):504-510.
FREE FULL TEXT
3. Koutkia P, Canavan B, Breu J, Grinspoon S. Growth hormone (GH) responses to GH-releasing hormonearginine testing in human immunodeficiency virus lipodystrophy. J Clin Endocrinol Metab. 2005;90(1):32-38.
FREE FULL TEXT
4. Koutkia P, Eaton K, You SM, Breu J, Grinspoon S. Growth hormone secretion among VIH infected patients:effects of gender, race and fat distribution. AIDS. 2006;20(6):855-862.
PUBMED
5. Rose n T, Bosaeus I, Tö lli J, Lindstedt G, Bengtsson BA. Increased body fat mass and decreased extracellular fluid volume in adults with growth hormone deficiency. Clin Endocrinol (Oxf) . 1993;38(1):63-71.
PUBMED
6. Salomon F, Cuneo RC, Hesp R, Sonksen PH. The effects of treatment with recombinant human growth hormone on body composition and metabolism in adults with growth hormone deficiency. N Engl JMed. 1989;321(26):1797-1803.
PUBMED
7. Merimee TJ, Hollander W, Fineberg SE. Studies of hyperlipidemia in the HGH-deficient state. Metabolism. 1972;21(11):1053-1061.
PUBMED
8. De Boer H, Blok GJ, Voerman HJ, De Vries PM, van der Veen EA. Body composition in adult growth hormone-deficient men, assessed by anthropometry and bioimpedance analysis. J Clin Endocrinol Metab. 1992;75(3):833-837.
ABSTRACT
9. Rose n T, Bengtsson BA. Premature mortality due to cardiovascular disease in hypopituitarism. Lancet. 1990;336(8710):285-288.
PUBMED
10. Bengtsson BA, Eden S, Lonn L, et al. Treatment of adults with growth hormone (GH) deficiency with recombinant human GH. J Clin Endocrinol Metab. 1993;76(2):309-317.
ABSTRACT
11. Friedman M, Byers SO, Rosenman RH, Li CH, Neuman R. Effect of subacute administration of human growth hormone on various serum lipid and hormone levels of hypercholesterolemic and normocholesterolemic subjects. Metabolism. 1974;23(10):905-912.
PUBMED
12. Blackett PR, Weech PK. McConathyWJ, Fesmire JD. Growth hormone in the regulation of hyperlipidemia. Metabolism. 1982;31(2):117-120.
PUBMED
13. Sesmilo G, Biller BM, Llevadot J, et al. Effects of growth hormone administration on inflammatory and other cardiovascular risk markers in men with growth hormone deficiency: a randomized, controlled clinical trial. Ann Intern Med. 2000;133(2):111-122.
FREE FULL TEXT
14. Johansson JO, Fowelin J, Landin K, Lager I, Bengtsson BA. Growth hormone-deficient adults are insulin-resistant. Metabolism. 1995;44(9):1126-1129.
PUBMED
15. Hew FL, Koschmann M, Christopher M, et al. Insulin resistance in growth hormone-deficient adults: defects in glucose utilization and glycogen synthase activity. J Clin Endocrinol Metab. 1996;81(2):555-564.
ABSTRACT
16. Johannsson G, Marin P, Lonn L, et al. Growth hormone treatment of abdominally obese men reduces abdominal fat mass, improves glucose and lipoprotein metabolism, and reduces diastolic blood pressure. J Clin Endocrinol Metab. 1997;82(3):727-734.
FREE FULL TEXT
17. Svensson J, Fowelin J, Landin K, Bengtsson BA, Johansson JO. Effects of seven years of GHreplacement therapy on insulin sensitivity in GHdeficient adults. J Clin Endocrinol Metab. 2002;87(5):2121-2127.
FREE FULL TEXT
18. Hwu CM, Kwok CF, Lai TY, et al. Growth hormone (GH) replacement reduces total body fat and normalizes insulin sensitivity in GH-deficient adults: a report of one-year clinical experience. J Clin Endocrinol Metab. 1997;82(10):3285-3292.
FREE FULL TEXT
19. Kotler DP, Muurahainen N, Grunfeld C, et al. Effects of growth hormone on abnormal visceral adipose tissue accumulation and dyslipidemia in VIHinfected patients. J Acquir Immune Defic Syndr. 2004;35(3):239-252.
PUBMED
20. Grunfeld C, Thompson M, Brown SJ, et al. Recombinant human growth hormone to treat VIHassociated adipose redistribution syndrome: 12 week induction and 24-week maintenance therapy. J Acquir Immune Defic Syndr. 2007;45(3):286-297.
PUBMED
21. Lo JC, Mulligan K, Noor MA, et al. The effects of low-dose growth hormone in VIH-infected men with fat accumulation: a pilot study. Clin Infect Dis. 2004;39(5):732-735.
FREE FULL TEXT
22. Hoffman DJ, Wang Z, Gallagher D, Heymsfield SB. Comparison of visceral adipose tissue mass in adult African Americans and whites. Obes Res. 2005;13(1):66-74.
PUBMED
23. Koutkia P, Canavan B, Breu J, Toriani M, Kissko J, Grinspoon S. Growthhormone-releasinghormoneinVIHinfectedmenwithlipodystrophy: arandomized,controlled trial. JAMA. 2004;292(2):210-218.
FREE FULL TEXT
24. Lo J, Dolan SE, Kanter JR, et al. Effects of obesity, body composition, and adiponectin on carotid intima-media thickness in healthy women. J Clin Endocrinol Metab. 2006;91(5):1677-1682.
FREE FULL TEXT
25. Wu AW, Revicki DA, Jacobson D, Malitz FE. Evidence for reliability, validity and usefulness of the Medical Outcomes Study VIH Health Survey (MOS-VIH). Qual Life Res. 1997;6(6):481-493.
PUBMED
26. Delate T, Coons SJ. The use of 2 health-related quality-of-life measures in a sample of persons infected with human immunodeficiency virus. Clin Infect Dis. 2001;32(3):E47-E52.
PUBMED
27. Djurhuus CB, Gravholt CH, Nielsen S, Pedersen SB, Moller N, Schmitz O. Additive effects of cortisol and growth hormone on regional and systemic lipolysis in humans. Am J Physiol Endocrinol Metab. 2004;286(3):E488-E494.
FREE FULL TEXT
28. Ottosson M, Vikman-Adolfsson K, Enerback S, Elander A, Bjorntorp P, Eden S. Growth hormone inhibits lipoprotein lipase activity in human adipose tissue. J Clin Endocrinol Metab. 1995;80(3):936-941.
ABSTRACT
29. Richelsen B, Pedersen SB, Borglum JD, Moller-Pedersen T, Jorgensen J, Jorgensen JO. Growth hormone treatment of obese women for 5 wk: effect on body composition and adipose tissue LPL activity. Am J Physiol. 1994;266(2 pt 1):E211-E216.
PUBMED
30. Schwarz JM, Mulligan K, Lee J, et al. Effects of recombinant human growth hormone on hepatic lipid and carbohydrate metabolism in VIH-infected patientswith fat accumulation. J Clin Endocrinol Metab. 2002;87(2):942.
FREE FULL TEXT
31. Brandou F, Aloulou I, Razimbaud A, Fedou C, Mercier J, Brun JF. Lower ability to oxidize lipids in adult patients with growth hormone (GH) deficiency: reversal under GH treatment. Clin Endocrinol (Oxf) . 2006;65(4):423-428.
PUBMED
32. Dolan SE, Frontera W, Librizzi J, et al. The effects of a supervised home-based aerobic and progressive resistance training regimen in VIH-infected women: a randomized trial. Arch Intern Med. 2006;166(11):1225-1231.
FREE FULL TEXT
33. Hadigan C, Corcoran C, Basgoz N, Davis B, Sax P, Grinspoon S. Metformin in the treatment of VIH lipodystrophy syndrome: a randomized controlled trial. JAMA. 2000;284(4):472-477.
FREE FULL TEXT
34. Hadigan C, Yawetz S, Thomas A, Havers F, Sax PE, Grinspoon S. Metabolic effects of rosiglitazone in VIH lipodystrophy: a randomized controlled trial. Ann Intern Med. 2004;140(10):786-794.
FREE FULL TEXT
35. Lo JC, Mulligan K, Noor MA, et al. The effects of recombinant human growth hormone on body composition and glucose metabolism in VIH-infected patientswith fat accumulation. J Clin Endocrinol Metab. 2001;86(8):3480-3487.
FREE FULL TEXT
36. Falutz J, Allas S, Kotler D, et al. Aplacebo-controlled, dose-ranging study of a growth hormone releasing factor in VIH-infected patients with abdominal fat accumulation. AIDS. 2005;19(12):1279-1287.
PUBMED
37. Falutz J, Allas S, Blot K, et al. Metabolic effects of a growth hormone releasing factor in patientswith VIH. N Engl J Med. 2007;357(23):2359-2370.
PUBMED
38. Soares DV, Spina LD, de Lima Oliveira Brasil RR, et al. Carotid artery intima-media thickness and lipid profile in adults with growth hormone deficiency after long-term growth hormone replacement. Metabolism. 2005;54(3):321-329.
PUBMED
39. Colao A, Di Somma C, Rota F, et al. Short-term effects of growth hormone (GH) treatment or deprivation on cardiovascular risk parameters and intimamedia thickness at carotid arteries in patients with severe GH deficiency. J Clin Endocrinol Metab. 2005;90(4):2056-2062.
FREE FULL TEXT
40. Colao A, Di Somma C, Cuocolo A, et al. Does a gender-related effect of growth hormone (GH) replacement exist on cardiovascular risk factors, cardiac morphology, and performance and atherosclerosis? results of a two-year open, prospective study in young adult men and women with severe GH deficiency. J Clin Endocrinol Metab. 2005;90(9):5146-5155.
FREE FULL TEXT
41. Napolitano LA, Schmidt D, Gotway MB, et al. Growth hormone enhances thymic function in VIH-1-infected adults. J Clin Invest. 2008;118(3):1085-1098.
PUBMED
42. Carr DB, Utzschneider KM, Boyko EJ, et al. A reduced-fat diet and aerobic exercise in Japanese Americans with impaired glucose tolerance decreases intraabdominal fat and improves insulin sensitivity but not beta-cell function. Diabetes. 2005;54(2):340-347.
FREE FULL TEXT
43. Fujimoto WY, Jablonski KA, Bray GA, et al. Body size and shape changes and the risk of diabetes in the diabetes prevention program. Diabetes. 2007;56(6):1680-1685.
FREE FULL TEXT
44. Park HS, Lee K. Greater beneficial effects of visceral fat reduction compared with subcutaneous fat reduction on parameters of the metabolic syndrome: a study of weight reduction programmes in subjects with visceral and subcutaneous obesity. Diabet Med. 2005;22(3):266-272.
PUBMED
45. Snyder S. Regulatory considerations for the treatment of lipodystrophy. In: Cheng B, Miller V, eds. Forum for Collaborative VIH Research Roundtable Discussion. Washington, DC: George Washington University School of Public Health and Health Services; 2004.
ARTICLE EN RAPPORT
Cette semaine dans le JAMA-Français
JAMA. 2008;300:471.
Texte Complet
|