 |
 |

PAGES DU PRATICIEN
Un homme de 39 ans ayant une lipodystrophie associée au VIH
Jon Fuller, MD, Intervenant.
JAMA. 2008;300(9):1056-1066
RÉSUMÉ
 |  |
La lipodystrophie associée au virus d’immunodéficience humaine (VIH) fait référence à une accumulation de graisses, également appelée lipohypertrophie, et à une perte de graisses également appelée lipoatrophie. Ces deux maladies peuvent être très perturbantes pour les patients et ont été associées à des troubles métaboliques telles la résistance à l’insuline et les hyperlipidémies. La prévalence de lipodystrophie associée au VIH va de 6% à 69% dans la littérature médicale. Bien qu'aucune association claires n’ait été établie entre les médicaments spécifiques et la lipohypertrophie liée au VIH , la stavudine et la zidovudine ont été impliquées dans le développement de la lipoatrophie liée au VIH. Le cas de M.B, un homme de 39 ans avec lipodystrophie associée au VIH dont les changements au niveaux du visage sont une cause de détresse importante, met en relief le besoin des cliniciens d'être à l’écoute de l'impact psychologique que la lipodystrophie peut avoir sur les patients, particulièrement parce que cela peut être une cause de découragement à l'adhérence aux prescriptions de médicaments antirétroviraux, ayant pour résultat un risque accru de développer une résistance virale.
DR LIBMAN: M.B a été diagnostiqué comme étant atteint par l'infection du virus d'immunodéficience humaine (VIH) en 1994. Le décompte de ses cellules CD4 à l’origine était de 80/µL, et il n'a eu aucune maladie opportuniste. Il a développée une anémie sévère en prenant de la zidovudine et une neuropathie périphérique en prenant de la didanosine et de la stavudine. Les autres médicaments précédemment reçus comprennent la lamivudine , indinavir et le ritonavir. En 2003 il a interrompu lui-même toutes ses médications en raison des effets toxiques précédemment mentionnés et du développement d’une perte de graisse au niveau de ses joues et d’un gain de graisse dans son cou, sa poitrine et son abdomen et d’une hyperlipidémie. Son décompte des cellules CD4 à ce moment était de 249/µL, et sa charge virale de l’ARN VIH était supérieure à 100 000 copies/ml.
En se fondant sur les précédents effets toxiques des médicaments que Mr B avait subis, dont la lipodystrophie et sur ses résultats du test génotype VIH (montrant de multiples mutations des inhibiteurs nucléosidiques de la transcriptase inverse (INTI), il débuta une combinaison de ténofovir, de lamivudine, d’efavirenz, et d’atazanavir amplifiée par du ritonavir. Peu après, il a développé une éruption cutanée diffuse due à l'efavirenz et plus tard due à la névirapine , et la thérapie anti-rétrovirale a été interrompue. En février 2004, M.B a commencé une combinaison de ténofovir, de lamivudine, de lopinavir/ritonavir, et de fosamprénavir, et il a continué ce régime jusqu’à présent .Tout en recevant le traitement, ses CD4 se sont accrus de 367/µL à 631/µL et ses charges virales se sont étendues de 111 à 826 copies/mL sans tendances particulières notées. Mr B précise qu’il a manqué uniquement "quelques" doses de médicament par mois. Avec le temps, il est devenu de plus en plus affecté par ses changements morphologiques corporels. Ces 4 dernières années, son poids allait de 80,5 à 85,1 kg.
Les antécédents médicaux à noter de M.B sont un abcès au doigt dû à un Staphylocoque Doré résistant à la méthicilline , une infection orale par herpès simplex , un molluscum contagiosum, des verrues communes, une rhinite allergique, et une pyélonéphrite aiguë. M.B également a une histoire ancienne de résultat positif de test cutané pour la tuberculose, pour laquelle il a reçu une prophylaxie par isoniazide, et d’infections par hépatite A et B. Ses antécédents médicaux familiaux sont un père et grand-père paternel atteints d'hyperlipidémie et de maladie coronarienne.
M.B prend actuellement du fosamprénavir , 700 mg, 2 comprimés deux fois par jour ;de la lamivudine , 300 mg une fois par jour ; lopinavir/ritanovir, 200 mg/50 mg , 3 comprimés deux fois par jour ; ténofovir, 300 mg une fois par jour; et fexofénadine, 60mg deux fois par jour, si nécessaire. En plus des réactions médicamenteuses défavorables énumérées ci-dessus, il a une histoire d’éruption cutanée due à la pénicilline.
M.B est employé en tant qu’ingénieur informatique et est actif dans des associations locales à but non lucratif pour les personnes porteuses du VIH. Il fume un quart de paquet de cigarettes par jour et prend 3 à 4 boissons alcoolisées par semaine. Il n’a pas d’antécédents d’usage de drogues .Le régime de Mr B est principalement végétarien.
Lors de l’examen clinique, la pression sanguine de Mr B était de 118/84 mm Hg, son pouls était de 72/mn et régulier et son poids de 88,7 Kg pour une taille de 178 cm. Son tour de taille était de 84 cm. Il avait des creux faciaux bilatéraux et un dépôt de graisse sur la nuque, la poitrine et la région abdominale. Le reste de ses résultats d’examen étaient normaux.
Les examens biologiques montraient un décompte normal des cellules sanguines. Et les résultats des tests des fonctions rénales et hépatiques étaient normaux. Son taux de glycémie à jeun était de 85 mg/dL (4,7 mmol/L), et son profil lipidique à jeun révélait un taux total de cholestérol de 291 mg/dL (7,53 mmol/L), avec des lipoprotéines à basse densité (LDL ) directement mesurées de 77 mg/dL (1,99 mmol /L) et des lipoprotéines de haute densité (HDL) de 31mg/dL (0,80 mmol /L), et un taux de triglycérides de 1130 mg/dL (12,7 mmol/L). Ses cellules CD4 était de 530/µL et sa charge virale d’ARN VIH était de 826 copies/mL .
MR B: SON POINT DE VUE
J’ai été diagnostiqué comme ayant le VIH en octobre 1994. A ce moment on m’a dit que j’étais non seulement VIH positif mais que j’avais aussi le SIDA. Mon décompte de cellules T était de 80. Avant cela, je voyageais l’été et j’ai commencé à être malade. J'ai suspecté que j’avais le VIH quand je suis tombé malade, mais je ne pouvais pas encore le dire à mes parents. Aussi quand le médecin m'a dit que j’étais non seulement positif, mais que j'avais aussi le SIDA, j'ai été en état de choc.
Quand j'ai été diagnostiqué, le docteur m'a dit que je risquais de ne plus avoir que 12 à 18 mois à vivre, aussi j’ai cherché tout de suite des soins médicaux. Le premier médicament que j’ai pris était la zidovudine. Cela devait faire 1 à 2 mois que j'avais commencé la zidovudine, lorsque j'ai développé une anémie sévère. Ils ont donc arrêté ce traitement et j’ai été transfusé. À la suite de cela j’ai été beaucoup mieux. Après cela, j'ai été mis sous d’autres médicaments, qui ont provoqué une neuropathie dans les pieds. Quand j'ai commencé l’efavirenz , tout mon corps entier a eu une éruption. Cela a pris plusieurs tentatives pour trouver un traitement me convenant.
Mes médecins m'ont dit qu'un nouveau médicament, [l’indinavir], venait de sortir. Mais j'ai dû pour cela passer par un système de loterie par courrier parce qu'il n'était pas encore disponible sur le marché. J’ai été accepté dans l’essai et c’est à ce moment là que mon histoire de lipodystrophie a débuté. C’était un changement graduel et lors de la seconde année passée sous indinavir, j’ai commencé à voir les effets.
J'ai remarqué que sous mon menton, j'avais une rétention de graisse, et mes joues devenaient un peu creuses. Mon docteur m’a dit que mes taux de cholestérol et de triglycérides étaient très élevés. J'ai une histoire de maladie cardiaque dans ma famille, je tiens cela de mon patrimoine génétique, mais je n'ai jamais pensé que ce serait aussi élevé. Mon régime étant principalement végétarien, j’ai bien compris que cela était lié aux médicaments.
Après plusieurs années passées en suivant le même régime, dans mon esprit je me sentais comme si j'avais trouvé la panacée. Bien que j'eus subi de grands changements des triglycérides et de graisse corporelle, cela semblait fonctionner. Mes cellules T étaient bonnes. Tous mes décomptes étaient bons. J'ai donc voulu être observant tant que je pourrais. Mais cela en vint à un point où j’ai réalisé que je ne pouvais plus suivre cette voie en raison de mon apparence et de la lipodystrophie. Il est très difficile de faire partie de la société et d’observer des changements dans votre corps. Les gens disent, « oh, vous avez pris du poids, mais seulement au niveau du visage. ». Je commençai à avoir peur de rencontrer des gens que je n’avais pas vus depuis longtemps. .
J’ai effectué toutes les recherches, je suis allé voir un chirurgien plasticien. Je suis en voie d’obtenir une assurance pour couvrir cela. Mais ils continuent de penser que c’est « cosmétique », mais je demande que l’on fasse une différence. C’est quelque chose d’absolument provoqué par les médicaments que je prends.
Je pense que pour quelqu'un ayant des origines asiatiques, il y a bien plus de stigmates liés à cette maladie. C’est un processus très difficile. Vous avez laissé tomber votre famille, vous êtes une sorte d’exclu dans la communauté, vos aînés vous regardent différemment. Et il est intéressant d’observer la façon dont le VIH et la sexualité marchent presque ensemble. En tant qu’homme asiatique homosexuel, mes parents m’ont dit "bien, une fois le VIH soigné, tu te marieras ».
Ce fut une dure route. Je pense que de nombreuses manières il faut s’accepter soi-même. Et cela prend un temps très long pour pouvoir accepter qui vous êtes.
AU CARREFOUR : QUESTIONS POUR LE DR FULLER
Quelles sont les complications à long terme du traitement lié à la maladie due au VIH ? Quelles sont les caractéristiques cliniques, l'épidémiologie, et la pathophysiologie du syndrome de lipodystrophie ? Que connait-on de leur effet sur l’image de soi-même et l’adhérence au traitement ? Comment la lipoatrophie et la lipohypertrophie devraient-elles être gérées ? Comment l'hyperlipidémie et l'intolérance au glucose devraient-elles être contrôlées dans ce contexte ? Un changement de médicaments anti-rétroviraux est-il utile pour n’importe laquelle de ces manifestations ? Le régime et l’exercice apportent-ils une aide face à ces manifestations? Que recommanderiez-vous à Mr B?
Dr FULLER: M.B a vécu avec un diagnostic de sida (sur la base de sur son premier compte de < 200/µL cellules CD4) pendant presque 15 années, a été traité avec les 3 classes principales de thérapie antirétrovirale, et a eu des complications de son traitement dont une anémie nécessitant une transfusion, une neuropathie périphérique, une hypertriglycéridémie , et une lipodystrophie, dont une lipoatrophie simultanée du visage et une lipohypertrophie du menton (« collier de cheval "). Bien qu’il y ait eu un temps où il a pensé qu'il pourrait tolérer toutes les complications tant que ses « chiffres étaient bons », les changements corporels qu'il a développés sont maintenant devenus si gênants pour lui qu'il cherche activement un remède à sa lipohypertrophie faciale au moyen d’une liposuccion.
Effets indésirables de la thérapie antirétrovirale
De nombreuses complications ont été associées à la thérapie antirétrovirale à long terme, dont certaines ont été éprouvées par Mr B. Dans certains cas, des liens clairs ont été établis entre des effets indésirables particuliers et des médicaments précis ou classes de médicaments, alors que dans d’autres cas ces relations ne sont pas si clairement définies. Comme discuté ci-dessus, une forme de lipodystrophie liée au VIH, de lipoatrophie liée au VIH, a été associée à la stavudine et à la zidovudine analogues à la thymidine, alors que la lipohypertrophie liée au VIH n'a pas été attribuée à des médicaments individuels.
Définition et manifestations cliniques
La Lipodystrophie est définie comme étant un « métabolisme anormal des graisses » (1) et, récemment, en tant que « dépôts ou émaciations du tissu adipeux », ou combinaisons anormales de ces changements, observées en conséquence d'une certaine utilisation d'inhibiteur de protéase (PI) chez les personnes atteintes du SIDA. ».1 La lipodystrophie associé au virus de l’immunodéficience humaine se rapporte à l’accumulation de graisses (lipohypertrophie liée au VIH) et à une perte de graisse (lipoatrophie liée au VIH). La lipohypertrophie liée au virus de l’immunodéficience humaine peut se manifester sous forme d’un accroissement d’un dépôt de graisse au niveau dorso-cervical ou « bosse du bison » (particulièrement observée chez les hommes, 2 un accroissement graisseux au niveau du menton ou « collier de cheval, » ou une augmentation des tissus du buste (particulièrement observé chez les femmes, 2 et/ou une adiposité centrale. Parce que l’adiposité centrale associée au VIH implique souvent un accroissement des tissus adipeux viscéraux plutôt qu’un accroissement des tissus adipeux abdominaux sous-cutanés, 3 ces patients affectés présentent une augmentation du périmètre abdominal avec des plis cutanés minces (Figure 1A), si l’on compare aux patients obèses VIH séronégatifs (ou séropositifs) pouvant avoir le même périmètre mais ayant des plis cutanés beaucoup plus épais (Figure 1B). L’accroissement du tissu adipeux viscéral peut avoir des conséquences importantes parce qu'il est associé à un plus grand risque de maladie coronarienne et de diabète et, 4 contribue à l'athérogenèse en augmentant les niveaux de l'inhibiteur 1 de l’activateur du plasminogène 5,6 et altère la fonction endothéliale. 7
|
|

|
Figure 1. Adiposité centrale associée au virus d’immunodéficience humaine
Les photographies représentent des patients autres que les patients faisant l’objet de la discussion de ce texte.
|
|
|
La lipoatrophie du virus de l’immunodéficience humaine peut se manifester comme une perte de tissu adipeux sous-cutané du visage, des membres, des fesses et/ou de l’abdomen, avec une proéminence visuelle des vaisseaux sanguins des extrémités connus sous le nom de pseudoveinomégalies 8 (Figure 2).
De petites séries et des rapports de cas de lipodystrophie associée au VIH documentent des dépôts graisseux supra-claviculaires, (9,10) une lipomatose épidurale spinale, 11 une accumulation intramusculaire, 12 et un angiolipome (nodules sous-cutanées tendres ou douloureux composés d'adipocytes mûrs et de petits vaisseaux sanguins). 13
|
|

|
Figure 2. Pseudoveinomégalie associée au virus d’immunodéficience humaine
Cette photographie représente un patient autre que le patient dont le cas est discuté ici.
|
|
|
Le syndrome de lipodystrophie a été associé à un risque accru d’hypertension du double au quintuple, 14,15 à une réduction de la densité osseuse (dans 1 étude, la densité de la colonne lombaire a été sensiblement réduite chez les 21 patients atteints d'infection par le VIH et de lipodystrophie comparée à 20 hommes séropositifs sans lipodystrophie et des témoins pour l’âge 18 et l’indice de masse corporelle ), une ostéonécrose 16 de la hanche dans jusqu'à 2% des patients traités, 17 et diverses perturbations métaboliques (hypercholestérolémie chez 10% à 27% des patients sous traitement VIH, hypertriglycéridémie chez 23% à 40% des patients traités pour le VIH, HDL cholestérol à moins de 35 mg/dL [<0,91 mmol/l] chez 19 à 27% des patients recevant un traitement VIH, un diabète chez 7% des patients infectés par le VIH avec lipoatrophie et une altération de la tolérance au glucose chez 35% des patients infectés par VIH. 3
L’habitus corporel peut être évalué par l'intermédiaire du rapport subjectif effectué par les patients et les examinateurs ; une analyse bioélectrique d'impédance, pouvant mesurer la composition globale du corps mais pas les données régionales de composition du corps ; une absorptiométrie à rayon X à double énergie (DEXA ), pouvant fournir des données sur la composition régionale du corps (par exemple, sur l'extrémité et la graisse du tronc) ; le scanner (CT) pouvant fournir des données quantifiables sur le tissu adipeux sous-cutané et le tissu adipeux viscéral ; et l’imagerie par résonance magnétique, employée dans quelques études afin de mesurer la graisse faciale. 18 Il est important de noter que les scans DEXA et CT sont coûteux, que les scanners impliquent une exposition importante aux rayons X, et que ni l'un ni l'autre n'ont normalisé les moyens d'interprétation dans ces buts. 3,19, 20 Bien que certaines études définissent la perte importante du tissu adipeux sous-cutané des membres comme la diminution de 20% par rapport à l’origine, au moins une étude a suggéré qu'un changement de 30% du tissu adipeux sous-cutané des membres est nécessaire pour être reconnu par les patients ou les cliniciens. 21 Les directives de la société internationale américaine sur le SIDA, AIDS Society (IAS-USA) et de la Société américaine des maladies infectieuses (IDSA) pour la gestion des complications métaboliques associées au VIH note 22,23, à l'heure actuelle, qu’« aucune technique n'a démontré une sensibilité, une spécificité, ou une valeur prédictive suffisante pour être recommandée dans l'évaluation et la surveillance clinique actuelle des changements de distribution de graisse corporelle ». M.B n'a pas eu de scanner quantitatif évaluant sa lipodystrophie en tant qu'élément d'une évaluation clinique, ce qui est approprié en l'absence de preuve de l'avantage d'un tel scanner.
Epidémiologie
Les Centres pour le Contrôle et la Prévention des Maladies définissent le syndrome d’amaigrissement du SIDA comme condition de définition du SIDA quand il a pour conséquence la perte involontaire de plus de 10% du poids corporel d’origine en association avec une diarrhée chronique ou une faiblesse liée à de la fièvre, mais aucune mention spécifique de tissu adipeux n'est incluse dans cette définition. 24 Le syndrome d’amaigrissement associé au virus de l’immunodéficience humaine lié à une diminution du poids corporel total et à la diarrhée a été identifié en Ouganda pendant les premières années de l'épidémie de SIDA, amenant certaines personnes à décrire les personnes africaines atteintes du SIDA comme ayant « la maladie de la maigreur ». 25,26 Cependant, il existe au moins une étude précoce sur le syndrome d’amaigrissement par perte surtout de tissu non adipeux, sans changements régionaux de la distribution de graisses ou une absence de rapport avec des traitements particuliers identifiés. 27
La première description publiée de perte de graisse associée à l’hyperlipidémie et à la résistance à l'insuline chez les personnes recevant un PI a été rapportée dans une étude transversale menée sur des patients ambulatoires en Australie. 28 Les auteurs ont comparé 116 hommes séropositifs recevant un PI à 32 hommes séropositifs qui ne recevaient pas de PI et à 47 hommes contrôlés VIH-négatifs, à l’aide d’un examen physique et un questionnaire pour évaluer la lipodystrophie et un scanner DEXA pour évaluer la composition corporelle.
Tandis que les patients sans PI et les témoins non infectés avaient une composition corporelle semblable, une lipodystrophie a été observée chez 64% des receveurs de PI après une moyenne de 13,9 mois, avec perte de graisse se produisant dans toutes les régions sauf l'abdomen en moyenne après 10 mois.
Les patients traités par PI ayant développé une lipodystrophie ont également eu des taux sensiblement plus élevés de cholestérol total, de triglycéride, d’insuline, et de C-peptide que ne l’ont eu les receveurs de PI sans lipodystrophie.
Les nombreux rapports ayant suivi ont estimé la prédominance de la lipodystrophie dans les cohortes infectées par VIH entre 6% à 69%, selon la définition de la lipodystrophie employée, si un composant métabolique tel que l'hyperlipidémie est inclus ou non, l'étape de l'infection par VIH étudiée, la durée et le type de traitement antirétroviral, les moyens utilisés pour la mesure et les caractéristiques de la conception d’étude (transversale contre prospective ; contrôlée contre non contrôlée). 29,32 Bien que ces évaluations basées sur une population de cohortes infectées par le VIH aient démontré une prédominance importante de la lipoatrophie liée au VIH et de la lipohypertrophie liée au VIH, au moins 4 grandes études comparant des individus infectés par le VIH aux populations témoins non infectées ont donné des différents résultats.
Ceux-ci ont inclus une cohorte multicentrique sur le SIDA (MACS), une étude multicentrique et prospective sur l'histoire naturelle de la maladie VIH. 33 ; la redistribution de graisses et le changement métabolique dans l'infection par le VIH (FRAM) chez les hommes et les femmes, chez lesquels les patients infectés par le VIH ont été comparés à des patients corrélés par l’âge inclus dans l’étude CARDIA, un essai prospectif sur le développement de la maladie coronarienne 34,35 ; et l'étude sur le VIH « Women’s Interagency HIV Study »(WIHS), une cohorte continue, multi-sites, prospective de femmes avec et sans infection par le VIH. 36 Ces études ont observé une augmentation de lipoatrophie chez les individus infectés par le VIH, comparée aux témoins mais ont également noté que les témoins ont eu une adiposité centrale beaucoup plus grande que les individus infectés par le VIH. De possibles explications à la différence entre l’impression clinique et les résultats d’étude pourraient être la modeste taille des échantillons (le nombre de personnes infectées par VIH dans ces études allait de 350 à 825 et les populations témoins allaient de 142 à 339) ou le ratio relativement bas de témoins pour étudier les patients (allant de 0,34 à 0,59). En plus, 3 des 4 études étaient transversales (ensemble les études FRAM et MACS) plutôt que longitudinales, et la quatrième (WIHS) impliquait des mesures par les praticiens mais pas avec des scanners. Contrairement à ces données, une étude menée sur 306 personnes infectées par le VIH et 107 témoins VIH-négatifs a trouvé que la quantité relative de tissu adipeux viscéral pour un indice de masse corporelle indiqué était plus haute plutôt que plus basse chez les patients infectés par le VIH. 37 Dans le cadre de ces données contradictoires sur les changements d’aspect du corps chez les personnes infectées par le VIH versus les témoins des études plus contrôlées et prospectives seront nécessaires pour aider à clarifier cette question.
Physiopathologie
En partant de la perspective de la pathogénie, la lipodystrophie n'est pas un syndrome d'unification, et même dans les catégories de lipoatrophie et de lipohypertrophie, des anomalies physiopathologiques multiples semblent être opératives. Dans le cas de la lipoatrophie, plusieurs anti rétroviraux, particulièrement la didanosine, la stavudine, et la zalcitabine, ont été associées à la toxicité mitochondriale en raison d'interférence avec la fonction de la polymérase de l’ADN mitochondrial, avec probablement association de symptômes comprenant la poly neuropathie, la perte de moelle, la pancréatite, la myopathie, la cardiomyopathie, l’acidose lactique, et la lipodystrophie. 38-40
Il existe de considérables preuves illustrant que la lipoatrophie est associée à l'utilisation de stavudine 44,45 et (à un faible degré) de zidovudine, 43,45 bien que le rapport avec la toxicité mitochondriale comme mécanisme pour la perte de tissu adipeux soit moins bien établi, puisque pas tous les médicaments impliqués (spécialement la didanosine) ont été associés à la lipoatrophie. L'association entre la lipoatrophie liée au VIH et les analogues de la thymidine a été récemment confirmée avec des données de protocole de groupe de tests cliniques sur le SIDA, 51,52 qui ont comparé 3 traitements économes. 46 Cette étude a constaté que la graisse des membres récupérait plus avec les agents économes en INTI (lopinavir/ritonavir plus efavirenz) qu'avec le traitement avec l'efavirenz plus 2 antirétriviraux ou lopinavir/ritonavir plus 2 anti rétroviraux. Deux-tiers des patients dans ces 2 derniers groupes recevaient de la zidovudine ou une administration prolongée de stavudine en plus de la lamivudine, fournissant une nouvelle preuve du rôle de ces médicaments dans la lipoatrophie. 46 (La stavudine a été également associée à la résistance à l'insuline et au dysfonctionnement mitochondrial même chez les patients non-infectés par le VIH.) 47
M.B présente une combinaison quelque peu inhabituelle de lipoatrophie faciale centrale et de lipohypertrophie cervicale antérieure. La cause de lipohypertrophie liée au VIH (particulièrement la lipohypertrophie centrale) est même moins bien comprise que ne l’est la lipoatrophie. La baisse du cortisol plasmatique sous déxaméthasone excluait le syndrome de cushing en tant que cause de l’élargissement du dépôt graisseux sur une série de 8 patients. 48 Les premiers études de cohorte identifièrent à titre d'essai l’exposition aux PI (particulièrement indinavir ) avec cette manifestation clinique, menant à l'utilisation répandue du terme « Crixbelly » (désignant une partie du nom commercial des indinavir, Crixivan) pour décrire toute adiposité centrale associée à un médicament pour le VIH, même chez les patients qui n'avaient été jamais soignés avec PI. 49 Cependant, l'association putative entre les PI et l’adiposité centrale semble avoir été plus une fonction des médicaments les plus répandus prescrits pour n'importe quelle cohorte de patients donnée au moment de l'étude que due à un rapport causal , des études plus récentes n'ayant trouvé aucun médicament ou catégorie particulière de médicaments lié à la lipohypertrophie. 48,50,51 D'autres mécanismes proposés pour la lipoatrophie liée au VIH et/ou la lipohypertrophie liée au VIH ont inclus la régulation altérée des adipocytes, 52,53 la production sans opposition des cytokines pro inflammatoires, 54 un dérèglement de la déshydrogénase hydroxystéroïde , 55 effets de traitement antirétroviral sur le système nerveux autonome, 56 polymorphismes dans l’hémochromatose , 57 polymérase mitochondriale, 58 ou MDR–I gènes, 59 l’interférence avec la protéine 1 régulatrice du stérol améliorant le bloquage avec le transporteur de l’insuline régulatrice du glucose GLUT-4, 19 ont diminué des taux d’expression d’IP dans l’ARN messager dans les tissus adipeux, 60 l'inhibition d'acide cis-(9)-rétinoïque, 61 l'inhibition du récepteur activé du proliférateur de peroxysome , 62 et des altérations de l’homéostasie des cellules T facteur de nécrose de tumorale. De nombreuses études ont suggéré qu'en plus des médicaments anti rétroviraux, certaines caractéristiques des patients peuvent également contribuer à la lipodystrophie. Les facteurs de risque de lipoatrophie ont inclus le traitement du VIH pendant plus de 2 années (odds ratio [OR ], 4.4), 45 une charge virale d’origine supérieure à 100 000 copies/ml ( OR , 4.3), 456 âge supérieur à 40 ans (OR , 3.2), 45 race blanche (OR , 5.4), 45 indice de masse corporelle inférieur à 24 64 ; décompte de cellules CD4 inférieur à 100/µL, 64 et le sexe féminin. 65,66 Les facteurs de risques de lipohypertrophie ont inclus la durée du traitement et les indicateurs de sévérité de la maladie 55 tels l'âge accru (OR ajusté, 2.02 à l’âge 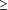 40 ans comparés à l'âge < 40 ans), 32 le gain en indice de masse corporelle (OR ajusté 3,14 pour le changement d’indice de masse corporelle 40 ans comparés à l'âge < 40 ans), 32 le gain en indice de masse corporelle (OR ajusté 3,14 pour le changement d’indice de masse corporelle 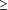 2 comparée au changement < 2), 32 et la quantité et durée de rétablissement de l’immunité. 2 comparée au changement < 2), 32 et la quantité et durée de rétablissement de l’immunité.
Impact sur l’image de soi-même et adhérence à la médication
Les cliniciens se sont rendu compte de l'impact psychologique négatif de la lipodystrophie, comme M.B le décrit, certains patients étant inquiets du fait que leurs changements corporels pourraient révéler leur sérodiagnostic VIH. Ces inquiétudes ont potentiellement des implications sérieuses pour la non adhérence au traitement et le risque en découlant de développer une résistance virale. Quand on a demandé si M.B était davantage préoccupé par les changements graisseux de son corps ou ses niveaux de lipides, il a répondu, « je m’étais davantage inquiété des changements de graisse. Il est être très difficile de faire partie de la société et de remarquer les changements de votre corps. Je n'étais pas ‘out’ au sujet de mon statut par rapport à beaucoup de personnes, ainsi il était bien plus difficile d’entendre les remarques des gens. » Pour obtenir un rendez vous, si vous envoyez une photo de vous-même, les gens disent, « le corps ne correspond pas au visage. Et alors on en arrive à un point où vous devez révéler votre statut ». 67
Des inquiétudes semblables concernant l'impact psychologique négatif de la lipodystrophie chez les patients ont été soulevées dans la littérature médicale, telle que « la seule possibilité que ces changements [lipodystrophiques] peuvent être dommageables au traitement ». 67 « Ces changements corporels donnent un aspect malsain qui ressemble à une déchéance, et sont un rappel de la maladie chez les patients infectés par le VIH autrement en bonne santé » 68 ; et « ce syndrome lipodystrophique (souvent graphiquement représenté lors des réunions médicales et dans les journaux) a inspiré des craintes et mené certains de nos patients à prendre des décisions imprudentes concernant le déclenchement de HAART [thérapie anti rétrovirale hautement active] par crainte d'être irréversiblement défiguré. » 69
De nombreuses études ont confirmé ces effets négatifs. Dans une étude menée sur 141 hommes homosexuels et infectés par le VIH dans les études de la cohorte d'Amsterdam, 50% ayant l’expérience d’une lipodystrophie ont rapporté une diminution sensible de l’activité sexuelle, appréciaient moins le sexe, se sentaient physiquement moins bien, et était moins confiants dans leurs relations. 70 Dans une étude qualitative menée sur 33 femmes et hommes hétérosexuels infectés par le VIH et présentant une lipoatrophie, les thèmes dominants qui en ont surgi comprenaient une dégradation de l’image de l’individu et de son amour-propre, des problèmes dans ses relations sociales et sexuelles, des menaces pour les lieux de contrôle, une révélation forcée du VIH, une démoralisation, une dépression, et une minimisation des cliniciens de l'importance de la lipoatrophie. 71
Une étude prospective menée sur 207 patients a révélé que l’adhérence au traitement du VIH était sensiblement associée à une altération du tissu adipeux, bien que la perception du patient des changements n'ait pas été toujours confirmée par le diagnostic médical des changements morphologiques. 72
Une analyse menée sur 277 patients d’une cohorte française initialement adhérents lors de l’interview 4 mois après le début du traitement a révélé que 20 mois après le début, 76,4% avaient rapporté au moins 1 symptôme lié à la lipodystrophie et 30% ne parvenaient pas à maintenir l’adhérence au traitement. Le nombre de symptômes de lipohypertrophie rapporté par les patients (mais pas la lipoatrophie) a été indépendamment associé à l'échec de l’adhérence.73,74
Gestion de la lipoatrophie et de la lipohypertrophie
Substitutions au médicament antirétroviral. En raison des associations connues entre le dysfonctionnement mitochondrial et la mort des cellules, 75 les chercheurs ont examiné la substitution d’autres médicaments pour les traitements antirétroviraux suspectés de causer une perte d’adipocyte. Dans des études d'observation, la stavudine a été associée à la perte du tissu adipeux sous-cutané, 76 et plusieurs études ont observé l'amélioration de la perte sous-cutanée de tissu adipeux par le changement de la stavudine par la zidovudine, le ténofovir, l'abacavir. 77-80
Plusieurs essais prospectifs ayant randomisé des patients sans antirétroviraux et des patients ayant des traitements antirétroviraux contenant de la zidovudine ou de la stavudine versus d’autres contenant du ténofovir, de l’ abacavir, ou de l’emtricitabine ont tous présenté moins de lipoatrophie avec les traitements ayant évité la stavudine ou la zidovudine. 81-83 D’autres études ont également révélé une baisse de lipoatrophie liée au HIV et du tissu adipeux viscéral lorsque les patients recevaient la névirapine et le pinavir/ritonavir comparé à la zidovudine et à la lamivudine plus lopinavir/ritonavir, bien que le total et les taux de LDL cholestérol aient été plus élevés dans le groupe névirapine. 84 Dans une étude, 81 patients présentant une lipoatrophie périphérique traitée avec PI ont été randomisés pour continuer les INTI mais pour substituer les PI avec l'abacavir, la névirapine, l'adéfovir, et l’hydroxyurée ou pour continuer tout le traitement (avec une option de permuter lors de la semaine 24). Ces patients randomisés par répartition initiale avaient sensiblement amélioré leurs lipides (le cholestérol total a diminué de 1,24 mmol/L [P=0,001] et les triglycérides de 29,2 mg/dl [0.33 mmol/L] [P=0.002]) et ont développé moins de graisse corporelle totale (- 1,6 et – 0,4 kilogrammes, respectivement ; P=0,006) et de prise de poids (- 2,8 et – 0,5 kilogrammes, respectivement ; P<0,001).
Le tissu adipeux sous-cutané des membres a été également sensiblement réduit (P=0,049), mais la graisse intra-abdominale n'a pas changé de manière significative. 85 Une autre étude menée sur 20 patients qui avaient changé les PI pour l'efavirenz n'a pas observé d’inversion de la lipodystrophie, bien que les taux de triglycéride et l’indice de résistance à l'insuline à jeun ait baissé de manière importante. 86
Les traitements du diabète et les hormones de croissance humaine. La metformine La metformine de la famille des biguanides sensibilisant à l’insuline diminue la libération de glucose hépatique et stimule la prise périphérique de glucose. 87 Chez les patients atteints de lipohypertrophie, la metformine a réduit l’aire moyenne sous la courbe (SEM) de l'insuline 120 minutes après le test de tolérance au glucose oral (- 2930 [912] contre -414 [432] µIU/mL [- 20349 {6334} contre -2875 {3000} pmol/L] ; P=0,01), poids (- 1.3 [0,6] contre 1,1 [0,4] kilogrammes ; P=0,005), et tension artérielle diastolique (- 5 [4] contre 5 [2] mmHg ; P=0,009) versus les témoins, respectivement. 88 Cependant, la metformine a eu des effets variés sur le tissu adipeux viscéral (allant d'une réduction 88,89 non significative à une réduction moyenne de 73 cm2 [P_0,01]). 90 Elle a été également associée à une diminution significative au niveau de la masse de graisse appendiculaire et devrait être employée avec prudence dans le traitement de la lipodystrophie, étant réservée aux patients ayant une graisse périphérique adéquate et une résistance marquée à l’insuline. 91 Il faut également prendre soin à surveiller le développement de l'acidose lactique chez les patients prenant la metformine en plus des INTI, puisque la metformine peut augmenter ce risque.
Thiazolinediones. Les thiazolinediones telles que la rosiglitazone peuvent théoriquement affecter la lipoatrophie liée au VIH par leur inhibition du récepteur du proliférateur de peroxisome activé, ce qui influence la transcription des gènes réglant l'adipogénèse et le métabolisme du glucose et des lipides, pouvant ainsi mener à un transport accru de glucose dans les muscles et à un accroissement de l’adipogénèse. 93 Cependant, les études sur la rosiglitazone ont eu des résultats mitigés en ce qui concerne les effets des rosiglitazones sur la lipoatrophie liée au VIH et les mesures métaboliques associées. 89,94,95 En revanche, la pioglitazone qui n'a pas été associée aux risques cardio-vasculaires notés avec la rosiglitazone, 96 a été associée à une augmentation de la graisse des membres de 0,45 kilogramme contre 0,04 kilogramme (P=0,13) chez 130 patients infectés par le VIH présentant une lipoatrophie auto-rapportée, randomisés sous pioglitazone versus le placebo (sauf si les patients prenaient également de la stavudine).
De nombreuses questions demeurent au sujet de l'utilisation de cette classe de médicaments dans la lipoatrophie liée au VIH, une revue récente notant que l'effet limité de la pioglitazone sur le tissu adipeux sous-cutané se produit seulement chez les patients ne prenant pas de stavudine et suggère que les thiazolinediones devraient seulement être employées dans la lipoatrophie liée au VIH si les patients ont également un diabète sucré. 97
Hormone de Croissance Humaine. L’hormone de croissance humaine (HGH) a été approuvée depuis 1996 dans le traitement des maladies de perte musculaire associées au VIH mais n'est pas approuvée dans la lipodystrophie. 98 Dans le cadre de la lipohypertrophie liée au VIH, l’hormone de croissance humaine s’est révélée diminuer le tissu adipeux viscéral (- 32,6 contre 0,5 cm2 ; P<0,001), diminuer la graisse des membres (0,04 contre 0,2 kg ; P<0,001), diminuer le cholestérol non HDL (- 13,0 contre –2,8 mg/dl ; P=0,02), et améliorer les profils des lipides, 99 mais, dans une étude menée sur 30 patients, elle a également été associée à de l'hyperglycémie (n=3), à des arthralgies (n=15), et à une rétention d’eau (n=4). 100 Le facteur stimulant de l’hormone de croissance humaine (tésamoreline) a été associé à une diminution du tissu adipeux viscéral (de 27,8 cm2 [- 32,9%] ; P<0,001), une amélioration du profil des lipides (le cholestérol total a diminué de 10 mg/dl [0,26 mmol/L] ; P<0,001), et des diminutions significatives de la «mauvaise image de leur ventre » chez les patients (P=0,03) sans effets indésirables significatifs, suggérant que cette approche peut être plus appropriée que l'utilisation de la HGH elle-même. 101 Cependant aucun essai n’a comparé les 2 traitements, et un traitement continu par la tésamoreline peut être nécessaire pour maintenir les bénéfices. 102
Liposuccion et utilisation des réajustements faciaux. Liposuccion. On a proposé la liposuccion en tant que moyen de réduction de la lipohypertrophie liée au VIH, particulièrement lorsque cela touche les régions antérieures ou postérieures cervicales ("cou de cheval » ou « bosse du bison »). Deux séries de cas (1 rapporté en résumé seulement) de 25 et 10 patients ont constaté que la liposuccion pour lipohypertrophie est souvent au début réussie, ou l’est au moins partiellement. 103,104 Cependant, une fréquence de la chirurgie répétitive a été observée chez presque 50% des patients, et on arrive difficilement à savoir si les problèmes postopératoires (pancréatite comprise, anémie, et pneumonie à pneumocoque chez 2 patients immunisés) sont connexes à ce procédé. 103,104 Il convient de noter que la liposuccion peut seulement être employée pour enlever la graisse sous-cutanée et que la liposuccion de graisse viscérale chez les patients non-infectés par le VIH n'a pas eu pour conséquence une amélioration des mesures métaboliques. 105
Réajustements faciaux. De nombreux agents sont disponibles pour traiter la lipoatrophie faciale, l’acide lactique poly-L, étant probablement le plus étudié et utilisé. L'acide lactique poly-L est un polymère synthétique, biodégradable, immunologiquement inerte, résorbable qui a été employé dans les sutures, les mailles, et des dispositifs de la libération des médicaments. 106 L’acide lactique poly-L stimule la production de multiplication de fibroblastes et de collagène, menant à une augmentation progressive et graduelle de volume. 68 Dans une étude prospective préliminaire menée sur 94 patients présentant une lipoatrophie faciale, l’acide lactique poly-L a été injecté dans les deux joues toutes les 2 semaines, avec comme critère primaire l’auto-perception des patients de l'amélioration sur une échelle analogique visuelle et avec la confirmation objective de l'amélioration fournie par des photographies en trois dimensions montrant une épaisseur cutanée accrue (augmentation moyenne, 1,99 mm) à la fin du traitement. Les patients ont rapporté un avantage allant jusqu'à 15 mois au delà de la dernière injection, bien que les mesures objectives du volume du tissu mou facial n'aient montré aucune amélioration importante. 68 Une seconde étude préliminaire prospective a inclus 50 patients recevant 4 séries d'injections à intervalles de deux semaines. En 6 semaines, 19% des patients ont observé un changement moyen de l'épaisseur cutanée totale de plus de 10 mm (le critère de l'étude), avec un pic à 48 semaines avec 61% de patients et diminuant graduellement à 43% des patients à la semaine 96. 107 Une étude contrôlée a randomisé 100 patients séropositifs présentant une lipoatrophie faciale modérée ou grave pour recevoir 4 injections d’acide lactique poly-L aux semaines 0, 2, 4, et 6 (groupe immédiat) ou pour recevoir les mêmes injections après un délai de 24 semaines (groupe reporté). En dépit des évaluations positives d'amélioration physique observée par les patients et les cliniciens, et des avantages en bien-être perçus par le patient, ainsi que du fonctionnement social et de la qualité de vie dans le groupe immédiat, les mesures objectives d'épaisseur faciale ont révélé seulement des améliorations modestes (changement de 2,2 mm de profondeur du tissu mou au niveau du maxillaire supérieur et de 1,0 mm à la base du septum nasal). 106 Les auteurs ont attribué cela probablement aux méthodes non normalisées employées pour mesurer l'épaisseur faciale mais ont suggéré que du point de vue du patient (quoique non en aveugle), il y a toujours un bénéfice de ce traitement. 106
Un deuxième produit de remplissage a été approuvé par la "Food and Drug Administration" aux USA en 2006 pour la correction à long terme de la lipoatrophie faciale liée au VIH, liée au traitement anti-rétroviral, l’hydroxyapatite de calcium. Une étude prospective préliminaire de l'hydroxyapatite de calcium chez 100 patients infectés par le VIH, a montré que tous les patients ont atteint le critère primaire non en aveugle d'efficacité (« un résultat esthétique amélioré » par comparaison au traitement préparatoire et les photographies après traitement à 1, 3, 6, et 12 mois) et le critère secondaire de l'épaisseur accrue des joues (qui montrait une augmentation de 2,2 – 2,5 mm à 12 mois ; P<0,001) ; aucun effet indésirable n'a été rapporté. 108
Directives pour la gestion des complications métaboliques et des changements corporels. Les directives de l’IAS (USA) et de l'IDSA suggèrent que le fait d'éviter les PI devrait être considéré chez les patients présentant des problèmes connus du métabolisme de glucose ou dont les parents au premier degré ont un diabète sucré, avec une attention à la substitution par la névirapine, 109 l'efavirenz 86 ou l’abacavir 110 pour améliorer la résistance à l’insuline. Les taux de glycémie à jeun devraient être mesurés avant et pendant le traitement avec les PI, et, chez les patients qui développent une hyperglycémie, les directives établies pour traiter cette maladie chez les individus non infectés par le VIH devraient être suivies. 111 Les tests de tolérance au glucose oral peuvent être pris en compte en plus des taux de glycémie à jeun, puisque certains patients atteints de VIH présentant une lipodystrophie (mais pas les témoins non infectés) avaient des taux de glycémie à jeun normaux, mais des résultats perturbés au test de tolérance au glucose (P=0,001 comparé aux témoins 112, qui sont également un facteur de risque de maladie cardio-vasculaire. 113
Certains PI (particulièrement le ritonavir, même en doses « d’amplification », 114 mais pas l’atazanavir 115 peuvent avoir comme conséquence une hyperlipidémie associée à un plus grand risque d'infarctus du myocarde; l’étude prospective de cohorte DAD intitulée « Data Collection on Adverse Events of Anti-HIV Drugs » a montré que chaque année passée à prendre un traitement PI était associé à un risque excédentaire de 16% d'infarctus du myocarde. 116 L'élévation en triglycérides de Mr B est sensiblement plus importante (11,30 mg/dl [12,7 mmol/L]) chez les patients ayant eu un infarctus du myocarde lors de cette étude, ayant une gamme interquartile de 142-345 mg/dl [1,6-3,9 mmol/L]. 116 Une analyse plus récente de ces données suggère qu’en se fondant sur cette étude non randomisée, certains INTI peuvent également contribuer à ce risque, l'abacavir étant lié à une augmentation de 90% et la didanosine à une hausse de 49%. 117
Comme avec n'importe quel patient ayant des taux de lipides élevés, il est important d’adhérer aux directives du programme éducatif national sur le cholestérol, 118 qui préconisent des modifications de l'hypertension, du diabète, du tabagisme, de l'obésité, de l'inactivité physique, et du régime, et des traitements médicamenteux lorsque la seule modification de ces facteurs ne suffit pas à atteindre des cibles individualisées. Les patients qui sont soignés à la fois avec des inhibiteurs de protéase et des statines (particulièrement simvastatine et lovastatine) peuvent avoir une réduction moyenne du métabolisme des statines médiée par les IP en raison d’un mauvais fonctionnement du système cytochrome P450; dans ce contexte, la pravastatine et l'atorvastatine sont les médicaments préférés. 118 Puisque l’efavirenz peut interférer avec le système P450, les doses de simvastatine, d’atorvastatine, ou de pravastatine peuvent devoir être augmentées en combinaison avec ce médicament. 119
Exercice et Régime. Plusieurs études sur l’exercice dans le contexte de la lipodystrophie, 120,121 parfois avec la metformine 122 ou la rosiglitazone, 123 ont montré des améliorations de l'adiposité centrale. Une analyse rétrospective sur le régime chez les patients infectés par le VIH avec et sans dépôt de graisse a indiqué qu'un régime de qualité, riche en fibre, en énergie et protéines, peut aider à prévenir les dépôts graisseux. 124 Une seconde étude prospective, menée sur 356 personnes infectées par le VIH et 162 témoins issus d’une communauté VIH négative, a noté que l’hypertriglycéridémie et les anomalies métaboliques étaient associées à une plus grande prise de graisse saturée (31 contre 27 g/jour), suggérant que cet élément diététique (plutôt qu'une réduction en graisse totale) devrait être particulièrement visé chez les individus infectés par le VIH présentant des anomalies métaboliques. 125 En se fondant sur ces résultats aussi bien que sur l'association de graisse saturée avec le risque de maladie cardiaque, M.B devrait réduire au minimum ses prises de graisses saturées. Un apport supplémentaire de nicotinate de chrome, 400 µg hebdomadaires pendant 16 semaines, a été également associé à la diminution de la résistance à l’insuline et à la réduction de la graisse du tronc chez les personnes infectées par le VIH. 126
Recommandations pour Mr B
Mr B s’est bien investi dans l’observance de son traitement, et je lui recommande de continuer de parler avec son médecin de l’importance des changements corporels pour sa qualité de vie. Son traitement médical actuel pour le VIH ne contribue probablement pas à aggraver la lipodystrophie, mais lui et son médecin pourraient envisager d'ajouter un inhibiteur de l’intégrase et/ou un bloqueur du corécepteur du récepteur 5 de la chimiokine CC, (si son virus est seulement CCR5-tropique) pour empêcher une persistance de la virémie à un faible taux d’évoluer vers une résistance manifeste (sans risquer encore d'autres effets indésirables dyslipidémiques). M.B devrait également savoir que même s’il a éprouvé des effets nuisibles significatifs dus au traitement antirétroviral, les données de l’essai stratégies pour la gestion des thérapies antirétrovirales suggèrent que rester sous traitement diminue réellement le risque de maladies cardio-vasculaires, rénales, ou hépatiques, même en présence d’anomalies métaboliques, soit en supprimant la réplication virale, ou probablement en améliorant la fonction immunitaire.127 M.B et son médecin pourraient également envisager d'ajouter du fénofibrate, de la niacine, ou de l'huile de poisson pour réduire ses triglycérides, particulièrement si l’on tient compte de ses antécédents familiaux de maladie cardiaque. M.B devrait continuer un régime sain, éviter les graisses saturées, et débuter une pratique régulière de l’aérobic. En conclusion, je recommande à M.B de continuer de lire et discuter des questions liées à ses soins, puisque la maladie du VIH et sa gestion continuent d’être un champ en pleine mutation. Puisque la lipohypertrophie affecte potentiellement son adhérence et change certainement son statut psychologique, je soutiendrais également ses efforts en faveur d’une liposuccion, bien que des difficultés considérables existent avec les assureurs dans ce secteur.
Recommandations pour les praticiens
J'encourage les cliniciens à interroger les patients au sujet de leurs perceptions des changements corporels; les cliniciens ne devraient pas présumer que ce qui semble nous être peu important peut l’être réellement pour les patients. Interrogez des patients sur les implications de ces changements sur leur adhérence au médicament, sur la confiance sociale, l’humeur, et les rapports sexuels et sociaux. Évitez les médicaments fortement impliqués (stavudine, zidovudine) ou leur substituer un autre agent, si possible, aux premiers signes de lipoatrophie. Soutenez les efforts pour les corrections faciales, si désirés et accessibles, et conseillez une liposuccion si la lipohypertrophie entraîne des douleurs, une restriction de la possibilité de mouvement, ou d'autres complications médicales.
QUESTIONS ET DISCUSSION
QUESTION : Y a-t-il eu une recherche sur les modes de mise à disposition de ces médicaments suspectés ? Leur demi-vie est-elle plus longue chez les patients ayant une lipohypertrophie et une atrophie ?
DR FULLER: C'est une question très intéressante, en particulier comme nous nous sommes rendus compte (l'efavirenz étant le meilleur exemple) que certaines populations métabolisent les antirétroviraux à différentes vitesses, donnant des profils potentiellement différents d'effets nuisibles pour la même dose de médicament, indiquant un besoin de réduire dans certains cas la dose pour maintenir une concentration thérapeutique. 128,129 Cependant, en passant en revue cette matière je n'ai trouvé rien qui rapporte spécifiquement les taux de médicament au développement d’une lipodystrophie.
QUESTION : Que peut-il être fait pour faire couvrir ces interventions « cosmétiques » par l’assurance maladie de sorte que les patients puissent réellement y avoir accès, d'autant plus qu'il est assez clair qu'ils sont une complication des médicaments nécessaires à leur infection ?
DR FULLER : Je n’ai pas connaissance que quiconque ait réussi à plaider pour que les compagnies d'assurance indemnisent les restructurations faciales, bien qu'il soit possible d'obtenir ce médicament gratuitement auprès des fabricants si les patients remplissent certains critères économiques. J'ai un tel patient, mais cela lui a coûté plusieurs milliers de dollars par séance d'injection (il en a eu 2) pour que les chirurgiens plasticiens accomplissent l’acte médical. D’autre part, si les patients avec dépôts de graisse au niveau dorso-cervical ou sur la partie antérieure du cou ressentent une diminution de leurs possibilités de mouvement, des apnées du sommeil, ou des douleurs, je pense que l'on pourrait établir un argument médical pour l'assurance. Il n'est pas facile de demander l'accord préalable ou de faire un recours à un refus, mais je pense que nous devons à nos patients de faire au moins la tentative, particulièrement quand il y a des problèmes fonctionnels en résultant.
MR B: Concernant la question de l'assurance, je suis allé en procès pour combattre mon assurance et j’ai essuyé deux refus. Avec l'aide d’une lettre de mon docteur et ainsi de suite, je suis toujours en procédure, mais il est étonnant à mes yeux que ma compagnie d'assurance regarde cela comme un produit de beauté, avec tous les effets secondaires dont je souffre. Même dans une salle remplie d'individus séropositifs, vous êtes encore stigmatisé par d'autres personnes séropositives en raison de votre apparence.
DR FULLER: Malheureusement, je ne pense pas que la tendance des assurances concernant les complications de l'infection par le VIH et son traitement évoluent dans la bonne direction. Récemment ces derniers mois, j'ai eu affaire à une compagnie d'assurances qui ne payera que le remplacement de testostérone chez les patients qui ont une insuffisance documentée s'ils ont également une ostéopénie, une perte de la masse maigre musculaire, ou une anémie, pas simplement pour des niveaux infra-physiologiques et ou une diminution de la fonction sexuelle. Aussi les restrictions pour certains de ces médicaments deviennent particulièrement sévères.
Informations sur les auteurs
Auteur correspondant: Dr Jon Fuller, clinique des maladies infectieuses, Boston Medical Center, One Boston Medical Center Place, Boston, MA 02118 (jfuller{at}bu.edu).
Liens financiers : Aucun déclaré.
Autres Contributions: nous remercions le patient de faire part de son histoire et de nous autoriser à la publier.
Affiliation des auteurs: le Dr Fuller est professeur associé, Boston University School of Medicine et membre de l’équipe du Center for HIV/AIDS Care and Research, Boston Medical Center, Boston, Massachusetts.
Rencontres Cliniques du centre médical Beth Israel Deaconess est produit et publié par Tom Delbanco, MD, Howard Libman, MD, Eileen E. Reynolds, MD, Amy N. Ship, MD, et Anjala V. Tess, MD. Risa B. Burns, MD, est le rédacteur en chef de la série.
Editeur de la Section Rencontres Cliniques : Margaret A. Winker, MD, Rédacteur en chef adjoint.
Cette conférence a eu lieu lors des « Medicine Grand Rounds » du Beth Israel Deaconess Medical Center, Boston, Massachusetts, le 20 mars 2008. .
FMC disponible en ligne sur www.jamaarchivescme.com et questions page 1089.
BIBLIOGRAPHIE
 |  |
1. Stedman’s Medical Dictionary. 28th ed. Baltimore, MD: LippincottWilliams & Wilkins; 2006. http://dictionary.webmd.com/terms/lipodystrophy.xml. Accessed July 31, 2008.
2. Muurahainen N, Falutz J, Santos G, et al.. The SALSA (Self-Ascertained Lipodystrophy Assessment) cohort: abnormalities in cases compared to controls [abstract]. Antivir Ther. 1999;4(suppl 2):44.
3. Grinspoon S, Carr A.. Cardiovascular risk and body-fat abnormalities in HIVinfected adults. N Engl J Med. 2005;352(1):48-62.
PUBMED
4. Bjorntorp P.. "Portal" adipose tissue as a generator of risk factors for cardiovascular disease and diabetes. Arteriosclerosis. 1990;10(4):493-496.
FREE FULL TEXT
5. Alessi MC, Peiretti F, Morange P, et al.. Production of plasminogen activator inhibitor 1 by human adipose tissue: possible link between visceral fat accumulation and vascular disease. Diabetes. 1997;46(5):860-867.
ABSTRACT
6. Mertens I, van der Planken M, Corthouts B, et al.. Visceral fat is a determinant of PAI-1 activity in diabetic and non-diabetic overweight and obese women. Horm Metab Res. 2001;33(10):602-607.
PUBMED
7. Hashimoto M, Akishita M, Eto M, et al.. The impairment of flow-mediated vasodilatation in obese men with visceral fat accumulation. Int J Obes Relat Metab Disord. 1998;22(5):477-484.
PUBMED
8. Panther LA. How HIV infection and its treatment affects the cardiovascular system: what is known, what is needed. Am J Physiol Heart Circ Physiol. 2002;283(1):H1-H4.
FREE FULL TEXT
9. Sekhar RV, Jahoor F, Pownall HJ, et al.. Severely dysregulated disposal of postprandial triacylglycerols exacerbates hypertriacylglycerolemia in HIV lipodystrophy syndrome. Am J Clin Nutr. 2005;81(6):1405-1410.
FREE FULL TEXT
10. Garc ’a-Benayas T. Blanco F, Gó mez-Viera JM, et al. Lipodystrophy bodyshape changes in a patient undergoing zidovudine monotherapy. AIDS. 2002;16(7):1087-1089.
PUBMED
11. Schürmann D, Rademaker J, Trottenberg T, et al.. Spinal epidural lipomatosis: a manifestation of HAART-associated lipodystrophy. AIDS. 2005;19(17):2052-2054.
PUBMED
12. Torriani M, Hadigan C, Jensen ME, Grinspoon S. Psoas muscle attenuation measurement with computed tomography indicates intramuscular fat accumulation in patients with the HIV-lipodystrophy syndrome. J Appl Physiol. 2003;95(3):1005-1010.
FREE FULL TEXT
13. Blanes M, Boix V. Belinchó n I, Portilla J. Angiolipomas, a rare manifestation of HIV-associated lipodystrophy. AIDS. 2008;22(4):552-554.
PUBMED
14. Sattler FR, Qian D, Louie S, et al.. Elevated blood pressure in subjects with lipodystrophy. AIDS. 2001;15(15):2001-2010.
PUBMED
15. Crane H, Grunfeld C, Harrington R, Kitahata M.. Lipoatrophy and lipohypertrophy are independently associated with hypertension: the effect of lipoatrophy but not lipohypertrophy on hypertension is independent of obesity. In: Program and abstracts of the 15th Conference on Retroviruses and Opportunistic Infections; February 3-6, 2008; Boston, MA. Abstract 946.16. Huang JS, Rietschel P, Hadigan CM, et al.. Increased abdominal visceral fat is associated with reduced bone density in HIV-infected menwith lipodystrophy. AIDS. 2001;15(8):975-982.
PUBMED
17. Roudie re L, Viard JP. Osteonecrosis of the hip, lipodystrophy and antiretroviral treatment. AIDS. 2000;14(13):2056.
PUBMED
18. Paton N, Yang Y, Sitoh Y, Naing O.. MRI measurement of the volume and anatomical distribution of facial fat depletion in lipodystrophy and wasting. In: Program and abstracts of the 12th Conference on Retroviruses and Opportunistic Infections; February 22-25, 2005; Boston, MA. Abstract 844.19. Carr A.. HIV lipodystrophy: risk factors, pathogenesis, diagnosis and management. AIDS. 2003;17(suppl 1):S141-S148.
PUBMED
20. Paton NI, Macallan DC, Jebb SA, et al.. Longitudinal changes in body composition measured with a variety of methods in patients with AIDS. J Acquir Immune Defic Syndr Hum Retrovirol. 1997;14(2):119-127.
PUBMED
21. Podzamczer D, Ferrer E, Martinez E, et al.. How much fat loss is needed for lipoatrophy to become clinically evident? In: Program and abstracts of the 15th Conference on Retroviruses and Opportunistic Infections; February 3-6, 2008; Boston, MA. Abstract 941.22. Schambelan M, Benson CA, Carr A, et al.. Management of metabolic complications associated with antiretroviral therapy for HIV-1 infection: recommendations of an International AIDS Society–USA panel. J Acquir Immune Defic Syndr. 2002;31(3):257-275.
PUBMED
23. Dube MP, Stein JH, Aberg JA, et al.. Guidelines for the evaluation and management of dyslipidemia in human immunodeficiency virus (HIV)-infected adults receiving antiretroviral therapy: recommendations of the HIV Medicine Association of the Infectious Disease Society of America and the Adult AIDS Clinical Trials Group. Clin Infect Dis. 2003;37(5):613-627.
FREE FULL TEXT
24. Centers for Disease Control. 1993 Revised classification system for HIV infection and expanded surveillance case definition for AIDS among adolescents and adults. MMWR Recomm Rep. 1992;41(RR-17):1-19.
PUBMED
25. Serwadda D, Mugerwa RD, Sewankambo NK, et al.. Slim disease: a new disease in Uganda and its association with HTLV-III infection. Lancet. 1985;2(8460):849-852.
PUBMED
26. Corcoran C, Grinspoon S.. Treatments for wasting in patients with the acquired immunodeficiency syndrome. N Engl J Med. 1999;340(22):1740-1750.
PUBMED
27. Kotler DP, Tierney AR, Wang J, Pierson RN. Magnitude of body-cell-mass depletion and the timing of death from wasting in AIDS. Am J Clin Nutr. 1989;50(3):444-447.
FREE FULL TEXT
28. Carr A, Samaras K, Burton S, et al.. A syndrome of peripheral lipodystrophy, hyperlipidaemia and insulin resistance in patients receiving HIV protease inhibitors. AIDS. 1998;12(7):F51-F58.
PUBMED
29. Hodgson LM, Ghattas H, Pritchitt H, et al.. Wasting and obesity in HIV outpatients. AIDS. 2001;15(17):2341-2342.
PUBMED
30. Heath KV, Hogg RS, Chan KJ, et al.. Lipodystrophy-associated morphological, cholesterol and triglyceride abnormalities in a population-based HIV/AIDS treatment database. AIDS. 2001;15(2):231-239.
PUBMED
31. Mutimura E, Steward A, Rheeder P, Crowther NJ. Metabolic function and the prevalence of lipodystrophy in a population of HIV-infected African subjects receiving highly active antiretroviral therapy. J Acquir Immune Defic Syndr. 2007;46(4):451-455.
PUBMED
32. Lichtenstein KA, Ward DJ, Moorman AC, et al.. Clinical assessment of HIVassociated lipodystrophy in an ambulatory population. AIDS. 2001;15(11):1389-1398.
PUBMED
33. Palella FJ, Cole SR, Chmiel JS, et al.. Anthropometrics and examiner-reported body habitus abnormalities in the Multicenter AIDS Cohort Study. Clin Infect Dis. 2004;38(6):903-907.
FREE FULL TEXT
34. Study of Fat Redistribution and Metabolic Change in HIV Infection (FRAM). Fat distribution in women with HIV infection. J Acquir Immune Defic Syndr. 2006;42(5):562-571.
PUBMED
35. Bacchetti P, Gripshover B, Grunfeld C.; Study of Fat Redistribution and Metabolic Change in HIV Infection (FRAM). Fat distribution in men with HIV infection. J Acquir Immune Defic Syndr. 2005;40(2):121-131.
PUBMED
36. Tien PC, Cole SR, Williams CM, et al.. Incidence of lipoatrophy and lipohypertrophy in the Women’s Interagency HIV Study. J Acquir Immune Defic Syndr. 2003;34(5):461-466.
PUBMED
37. Joy T, Keogh HM, Hadigan C, et al.. Relation of body composition to body mass index in HIV-infected patients with metabolic abnormalities. J Acquir Immune Defic Syndr. 2008;47(2):174-184.
PUBMED
38. Brinkman K, Smeitink JA, Romijn JA, Reiss P. Mitochondrial toxicity induced by nucleoside-analogue reverse-transcriptase inhibitors is a key factor in the pathogenesis of antiretroviral-therapy-related lipodystrophy. Lancet. 1999;354(9184):1112-1115.
PUBMED
39. Walker UA, Bickel M, Volksbeck L, et al.. Evidence of nucleoside analogue reverse transcriptase inhibitor-associated genetic and structural defects of mitochondria in adipose tissue of HIV-infected patients. J Acquir Immune Defic Syndr. 2002;29(2):117-121.
PUBMED
40. McComsey G.. Update on mitochondrial toxicity of antiretrovirals and its link to lipodystrophy. AIDS Rev. 2002;4(3):140-147.
PUBMED
41. Savès M, Raffi F, Capeau J, et al.. Factors related to lipodystrophy and metabolic alterations in patients with human immunodeficiency virus infection receiving highly active antiretroviral therapy. Clin Infect Dis. 2002;34(10):1396-1405.
PUBMED
42. Joly V, Flandre P, Meiffredy V, et al.. Increased risk of lipoatrophy under stavudine in HIV-1-infected patients: results of a substudy from a comparative trial. AIDS. 2002;16(18):2447-2454.
PUBMED
43. Hammond E, McKinnon B, Pace C, et al.. Influence of NRTI choice and efavirenz vs. lopinavir treatment options on lipoatrophy-associated adipose tissue toxicity: a longitudinal study. In: Program and abstracts of the 15th Conference on Retroviruses and Opportunistic Infections; February 3-6, 2008; Boston, MA. Abstract 939.44. Mallal SA, John M, Moore CB, et al.. Contribution of nucleoside analogue reverse transcriptase inhibitors to subcutaneous fat wasting in patients with HIV infection. AIDS. 2000;14(10):1309-1316.
PUBMED
45. Bogner JR, Vielhauer V, Beckmann RA, et al.. Stavudine versus zidovudine and the development of lipodystrophy. J Acquir Immune Defic Syndr. 2001;27(3):237-244.
PUBMED
46. Riddler SA, Haubrich R, DiRienzo AG, et al.. Class-sparing regimens for initial treatment of HIV infection. N Engl J Med. 2008;358(20):2095-2106.
PUBMED
47. Fleischman A, Johnsen S, Systrom DM, et al.. Effects of a nucleoside reverse transcriptase inhibitor, stavudine, on glucose disposal and mitochondrial function in muscle of healthy adults. Am J Physiol Endocrinol Metab. 2007;292(6):E1666-E1673 Published online February 6, 2007.48. Lo JC, Mulligan K, Tai VW, et al.. "Buffalo hump" in men with HIV-1 infection. Lancet. 1998;351(9106):867-870.
PUBMED
49. Madge S, Kinloch-de-Loes S, Mercey D, et al.. Lipodystrophy in patients naive to HIV protease inhibitors. AIDS. 1999;13(6):735-737.
PUBMED
50. Martinez E, Mocroft A. Garc ’a-Benayas T. Blanco F, Gó mez-Viera JM, et al. Lipodystrophy bodyshape changes in a patient undergoing zidovudine monotherapy. AIDS. 2002;16(7):1087-1089.
PUBMED
11. Schürmann D, Rademaker J, Trottenberg T, et al.. Spinal epidural lipomatosis: a manifestation of HAART-associated lipodystrophy. AIDS. 2005;19(17):2052-2054.
PUBMED
12. Torriani M, Hadigan C, Jensen ME, Grinspoon S. Psoas muscle attenuation measurement with computed tomography indicates intramuscular fat accumulation in patients with the HIV-lipodystrophy syndrome. J Appl Physiol. 2003;95(3):1005-1010.
FREE FULL TEXT
13. Blanes M, Boix V. Belinchó n I, Portilla J. Angiolipomas, a rare manifestation of HIV-associated lipodystrophy. AIDS. 2008;22(4):552-554.
PUBMED
14. Sattler FR, Qian D, Louie S, et al.. Elevated blood pressure in subjects with lipodystrophy. AIDS. 2001;15(15):2001-2010.
PUBMED
15. Crane H, Grunfeld C, Harrington R, Kitahata M.. Lipoatrophy and lipohypertrophy are independently associated with hypertension: the effect of lipoatrophy but not lipohypertrophy on hypertension is independent of obesity. In: Program and abstracts of the 15th Conference on Retroviruses and Opportunistic Infections; February 3-6, 2008; Boston, MA. Abstract 946.16. Huang JS, Rietschel P, Hadigan CM, et al.. Increased abdominal visceral fat is associated with reduced bone density in HIV-infected menwith lipodystrophy. AIDS. 2001;15(8):975-982.
PUBMED
17. Roudie re L, Viard JP. Osteonecrosis of the hip, lipodystrophy and antiretroviral treatment. AIDS. 2000;14(13):2056.
PUBMED
18. Paton N, Yang Y, Sitoh Y, Naing O.. MRI measurement of the volume and anatomical distribution of facial fat depletion in lipodystrophy and wasting. In: Program and abstracts of the 12th Conference on Retroviruses and Opportunistic Infections; February 22-25, 2005; Boston, MA. Abstract 844.19. Carr A.. HIV lipodystrophy: risk factors, pathogenesis, diagnosis and management. AIDS. 2003;17(suppl 1):S141-S148.
PUBMED
20. Paton NI, Macallan DC, Jebb SA, et al.. Longitudinal changes in body composition measured with a variety of methods in patients with AIDS. J Acquir Immune Defic Syndr Hum Retrovirol. 1997;14(2):119-127.
PUBMED
21. Podzamczer D, Ferrer E, Martinez E, et al.. How much fat loss is needed for lipoatrophy to become clinically evident? In: Program and abstracts of the 15th Conference on Retroviruses and Opportunistic Infections; February 3-6, 2008; Boston, MA. Abstract 941.22. Schambelan M, Benson CA, Carr A, et al.. Management of metabolic complications associated with antiretroviral therapy for HIV-1 infection: recommendations of an International AIDS Society–USA panel. J Acquir Immune Defic Syndr. 2002;31(3):257-275.
PUBMED
23. Dube MP, Stein JH, Aberg JA, et al.. Guidelines for the evaluation and management of dyslipidemia in human immunodeficiency virus (HIV)-infected adults receiving antiretroviral therapy: recommendations of the HIV Medicine Association of the Infectious Disease Society of America and the Adult AIDS Clinical Trials Group. Clin Infect Dis. 2003;37(5):613-627.
FREE FULL TEXT
24. Centers for Disease Control. 1993 Revised classification system for HIV infection and expanded surveillance case definition for AIDS among adolescents and adults. MMWR Recomm Rep. 1992;41(RR-17):1-19.
PUBMED
25. Serwadda D, Mugerwa RD, Sewankambo NK, et al.. Slim disease: a new disease in Uganda and its association with HTLV-III infection. Lancet. 1985;2(8460):849-852.
PUBMED
26. Corcoran C, Grinspoon S.. Treatments for wasting in patients with the acquired immunodeficiency syndrome. N Engl J Med. 1999;340(22):1740-1750.
PUBMED
27. Kotler DP, Tierney AR, Wang J, Pierson RN. Magnitude of body-cell-mass depletion and the timing of death from wasting in AIDS. Am J Clin Nutr. 1989;50(3):444-447.
FREE FULL TEXT
28. Carr A, Samaras K, Burton S, et al.. A syndrome of peripheral lipodystrophy, hyperlipidaemia and insulin resistance in patients receiving HIV protease inhibitors. AIDS. 1998;12(7):F51-F58.
PUBMED
29. Hodgson LM, Ghattas H, Pritchitt H, et al.. Wasting and obesity in HIV outpatients. AIDS. 2001;15(17):2341-2342.
PUBMED
30. Heath KV, Hogg RS, Chan KJ, et al.. Lipodystrophy-associated morphological, cholesterol and triglyceride abnormalities in a population-based HIV/AIDS treatment database. AIDS. 2001;15(2):231-239.
PUBMED
31. Mutimura E, Steward A, Rheeder P, Crowther NJ. Metabolic function and the prevalence of lipodystrophy in a population of HIV-infected African subjects receiving highly active antiretroviral therapy. J Acquir Immune Defic Syndr. 2007;46(4):451-455.
PUBMED
32. Lichtenstein KA, Ward DJ, Moorman AC, et al.. Clinical assessment of HIVassociated lipodystrophy in an ambulatory population. AIDS. 2001;15(11):1389-1398.
PUBMED
33. Palella FJ, Cole SR, Chmiel JS, et al.. Anthropometrics and examiner-reported body habitus abnormalities in the Multicenter AIDS Cohort Study. Clin Infect Dis. 2004;38(6):903-907.
FREE FULL TEXT
34. Study of Fat Redistribution and Metabolic Change in HIV Infection (FRAM). Fat distribution in women with HIV infection. J Acquir Immune Defic Syndr. 2006;42(5):562-571.
PUBMED
35. Bacchetti P, Gripshover B, Grunfeld C.; Study of Fat Redistribution and Metabolic Change in HIV Infection (FRAM). Fat distribution in men with HIV infection. J Acquir Immune Defic Syndr. 2005;40(2):121-131.
PUBMED
36. Tien PC, Cole SR, Williams CM, et al.. Incidence of lipoatrophy and lipohypertrophy in the Women’s Interagency HIV Study. J Acquir Immune Defic Syndr. 2003;34(5):461-466.
PUBMED
37. Joy T, Keogh HM, Hadigan C, et al.. Relation of body composition to body mass index in HIV-infected patients with metabolic abnormalities. J Acquir Immune Defic Syndr. 2008;47(2):174-184.
PUBMED
38. Brinkman K, Smeitink JA, Romijn JA, Reiss P. Mitochondrial toxicity induced by nucleoside-analogue reverse-transcriptase inhibitors is a key factor in the pathogenesis of antiretroviral-therapy-related lipodystrophy. Lancet. 1999;354(9184):1112-1115.
PUBMED
39. Walker UA, Bickel M, Volksbeck L, et al.. Evidence of nucleoside analogue reverse transcriptase inhibitor-associated genetic and structural defects of mitochondria in adipose tissue of HIV-infected patients. J Acquir Immune Defic Syndr. 2002;29(2):117-121.
PUBMED
40. McComsey G.. Update on mitochondrial toxicity of antiretrovirals and its link to lipodystrophy. AIDS Rev. 2002;4(3):140-147.
PUBMED
41. Savès M, Raffi F, Capeau J, et al.. Factors related to lipodystrophy and metabolic alterations in patients with human immunodeficiency virus infection receiving highly active antiretroviral therapy. Clin Infect Dis. 2002;34(10):1396-1405.
PUBMED
42. Joly V, Flandre P, Meiffredy V, et al.. Increased risk of lipoatrophy under stavudine in HIV-1-infected patients: results of a substudy from a comparative trial. AIDS. 2002;16(18):2447-2454.
PUBMED
43. Hammond E, McKinnon B, Pace C, et al.. Influence of NRTI choice and efavirenz vs. lopinavir treatment options on lipoatrophy-associated adipose tissue toxicity: a longitudinal study. In: Program and abstracts of the 15th Conference on Retroviruses and Opportunistic Infections; February 3-6, 2008; Boston, MA. Abstract 939.44. Mallal SA, John M, Moore CB, et al.. Contribution of nucleoside analogue reverse transcriptase inhibitors to subcutaneous fat wasting in patients with HIV infection. AIDS. 2000;14(10):1309-1316.
PUBMED
45. Bogner JR, Vielhauer V, Beckmann RA, et al.. Stavudine versus zidovudine and the development of lipodystrophy. J Acquir Immune Defic Syndr. 2001;27(3):237-244.
PUBMED
46. Riddler SA, Haubrich R, DiRienzo AG, et al.. Class-sparing regimens for initial treatment of HIV infection. N Engl J Med. 2008;358(20):2095-2106.
PUBMED
47. Fleischman A, Johnsen S, Systrom DM, et al.. Effects of a nucleoside reverse transcriptase inhibitor, stavudine, on glucose disposal and mitochondrial function in muscle of healthy adults. Am J Physiol Endocrinol Metab. 2007;292(6):E1666-E1673 Published online February 6, 2007.48. Lo JC, Mulligan K, Tai VW, et al.. "Buffalo hump" in men with HIV-1 infection. Lancet. 1998;351(9106):867-870.
PUBMED
49. Madge S, Kinloch-de-Loes S, Mercey D, et al.. Lipodystrophy in patients naive to HIV protease inhibitors. AIDS. 1999;13(6):735-737.
PUBMED
50. Martinez E, Mocroft A. Garc ’a-Viejo MA, et al. Risk of lipodystrophy in HIV-1-infected patients treated with protease inhibitors: a prospective cohort study. Lancet. 2001;357(9256):592-598.
PUBMED
51. Engelson ES, Kotler DP, Tan YX, et al.. Fat distribution in HIV-infected patients reporting truncal enlargement quantified by whole-body magnetic resonance imaging. Am J Clin Nutr. 1999;69(6):1162-1169.
FREE FULL TEXT
52. Vigouroux C, Maachi M. Nguyse¡ n TH, et al. Serum adipocytokines are related to lipodystrophy and metabolic disorders in HIV-infected men under antiretroviral therapy. AIDS. 2003;17(10):1503-1511.
PUBMED
53. Sweeney LL, Brennan AM, Mantzoros CS. The role of adipokines in relation to HIV lipodystrophy. AIDS. 2007;21(8):895-904.
PUBMED
54. Lichtenstein KA. Human immunodeficiency virus-associated lipoatrophy: letting the genome out of the bottle. J Infect Dis. 2008;197(6):784-786.
FREE FULL TEXT
55. Lichtenstein KA. Redefining lipodystrophy syndrome: risks and impact on clinical decision making. J Acquir Immune Defic Syndr. 2005;39(4):395-400.
PUBMED
56. Fliers E, Sauerwein HP, Romijn JA, et al.. HIV-associated adipose redistribution syndrome as a selective autonomic neuropathy. Lancet. 2003;362(9397):1758-1760.
PUBMED
57. Hulgan T, Tebas P, Canter JA, et al.. Hemochromatosis gene polymorphisms, mitochondrial haplogroups, and peripheral lipoatrophy during antiretroviral therapy. J Infect Dis. 2008;197(6):858-866.
PUBMED
58. Chiappini F, Teicher E, Vitecoq D, Lemoine A.. Relationship between polymerase gamma polymorphisms and ART-induced lipodystrophy in HIV-infected patients: a case-control study. In: Program and abstracts of the 15th Conference on Retroviruses and Opportunistic Infections; February 3-6, 2008; Boston, MA. Abstract 945.59. De Luca A, Di Giambenedetto S, Schwarz J, et al.. The effect of polymorphism of the MDR-1 gene on the long-term risk of lipodystrophy and dyslipidemias in HIV-infected patients starting ART. In: Program and abstracts of the 13th Conference on Retroviruses and Opportunistic Infections; February 5-8, 2006; Denver, CO. Abstract 766.60. Lindegaard B, Frydelund-Larsen L, Hansen AB, et al.. Low levels of lipin mRNA expression in adipose tissues from HIV-infected patients with lipodystrophy. In: Program and abstracts of the 12th Conference on Retroviruses and Opportunistic Infections; February 22-25, 2005; Boston, MA. Abstract 845.61. Carr A, Samaras K, Chisholm DJ, Cooper DA. Pathogenesis of HIV-1-protease inhibitor-associated peripheral lipodystrophy, hyperlipidaemia, and insulin resistance. Lancet. 1998;351(9119):1881-1883.
PUBMED
62. Kannisto K, Sutinen J, Korsheninnikova E, et al.. Expression of adipogenic transcription factors, peroxisome proliferator-activated receptor gamma co-activator 1, IL-6 and CD45 in subcutaneous adipose tissue in lipodystrophy associated with highly active antiretroviral therapy. AIDS. 2003;17(12):1753-1762.
PUBMED
63. Ledru E, Christeff N, Patey O, et al.. Alteration of tumor necrosis factor- ’a-Viejo MA, et al. Risk of lipodystrophy in HIV-1-infected patients treated with protease inhibitors: a prospective cohort study. Lancet. 2001;357(9256):592-598.
PUBMED
51. Engelson ES, Kotler DP, Tan YX, et al.. Fat distribution in HIV-infected patients reporting truncal enlargement quantified by whole-body magnetic resonance imaging. Am J Clin Nutr. 1999;69(6):1162-1169.
FREE FULL TEXT
52. Vigouroux C, Maachi M. Nguyse¡ n TH, et al. Serum adipocytokines are related to lipodystrophy and metabolic disorders in HIV-infected men under antiretroviral therapy. AIDS. 2003;17(10):1503-1511.
PUBMED
53. Sweeney LL, Brennan AM, Mantzoros CS. The role of adipokines in relation to HIV lipodystrophy. AIDS. 2007;21(8):895-904.
PUBMED
54. Lichtenstein KA. Human immunodeficiency virus-associated lipoatrophy: letting the genome out of the bottle. J Infect Dis. 2008;197(6):784-786.
FREE FULL TEXT
55. Lichtenstein KA. Redefining lipodystrophy syndrome: risks and impact on clinical decision making. J Acquir Immune Defic Syndr. 2005;39(4):395-400.
PUBMED
56. Fliers E, Sauerwein HP, Romijn JA, et al.. HIV-associated adipose redistribution syndrome as a selective autonomic neuropathy. Lancet. 2003;362(9397):1758-1760.
PUBMED
57. Hulgan T, Tebas P, Canter JA, et al.. Hemochromatosis gene polymorphisms, mitochondrial haplogroups, and peripheral lipoatrophy during antiretroviral therapy. J Infect Dis. 2008;197(6):858-866.
PUBMED
58. Chiappini F, Teicher E, Vitecoq D, Lemoine A.. Relationship between polymerase gamma polymorphisms and ART-induced lipodystrophy in HIV-infected patients: a case-control study. In: Program and abstracts of the 15th Conference on Retroviruses and Opportunistic Infections; February 3-6, 2008; Boston, MA. Abstract 945.59. De Luca A, Di Giambenedetto S, Schwarz J, et al.. The effect of polymorphism of the MDR-1 gene on the long-term risk of lipodystrophy and dyslipidemias in HIV-infected patients starting ART. In: Program and abstracts of the 13th Conference on Retroviruses and Opportunistic Infections; February 5-8, 2006; Denver, CO. Abstract 766.60. Lindegaard B, Frydelund-Larsen L, Hansen AB, et al.. Low levels of lipin mRNA expression in adipose tissues from HIV-infected patients with lipodystrophy. In: Program and abstracts of the 12th Conference on Retroviruses and Opportunistic Infections; February 22-25, 2005; Boston, MA. Abstract 845.61. Carr A, Samaras K, Chisholm DJ, Cooper DA. Pathogenesis of HIV-1-protease inhibitor-associated peripheral lipodystrophy, hyperlipidaemia, and insulin resistance. Lancet. 1998;351(9119):1881-1883.
PUBMED
62. Kannisto K, Sutinen J, Korsheninnikova E, et al.. Expression of adipogenic transcription factors, peroxisome proliferator-activated receptor gamma co-activator 1, IL-6 and CD45 in subcutaneous adipose tissue in lipodystrophy associated with highly active antiretroviral therapy. AIDS. 2003;17(12):1753-1762.
PUBMED
63. Ledru E, Christeff N, Patey O, et al.. Alteration of tumor necrosis factor- Tcell homeostasis following potent antiretroviral therapy: contribution to the development of human immunodeficiency virus-associated lipodystrophy syndrome. Blood. 2000;95(10):3191-3198.
FREE FULL TEXT
64. Lichtenstein KA, Delaney KM, Armon C, et al.. Incidence of and risk factors for lipoatrophy (abnormal fat loss) in ambulatory HIV-1-infected patients. J Acquir Immune Defic Syndr. 2003;32(1):48-56.
PUBMED
65. Kotler DP, Thea DM, Heo M, et al.. Relative influences of sex, race, environment, and HIV infection on body composition in adults. Am J Clin Nutr. 1999;69(3):432-439.
FREE FULL TEXT
66. Wanke C, Jacobsen D, Knox T, Gorbach S.. Prevalence of fat deposition and fat atrophy in a cohort of HIV-infected men and women. In: Program and abstracts of the 7th Conference on Retroviruses and Opportunistic Infections; January 30–February 4, 2000; San Francisco, CA. Abstract 24.67. Shevitz A, Wanke CA, Falutz J, Kotler DP. Clinical perspectives on HIVassociated lipodystrophy syndrome: an update. AIDS. 2001;15(15):1917-1930.
PUBMED
68. Lafaurie M, Dolivo M, Porcher R, et al.. Treatment of facial lipoatrophy with intradermal injections of polylactic acid in HIV-infected patients. J Acquir Immune Defic Syndr. 2005;38(4):393-398.
PUBMED
69. Khara M, Conway B.. Morphologic changes in HIV-infected men: sorting fact from fiction. J Acquir Immune Defic Syndr. 2005;40(2):119-120.
PUBMED
70. Dukers NH, Stolte IG, Albrecht N, et al.. The impact of experiencing lipodystrophy on the sexual behaviour and well-being among HIV-infected homosexual men. AIDS. 2001;15(6):812-813.
PUBMED
71. Collins E, Wagner C, Walmsley S.. Psychosocial impact of the lipodystrophy syndrome in HIV infection. AIDS Read. 2000;10(9):546-551.
PUBMED
72. Ammassari A, Antinori A, Cozzi-Lepri A, et al.. Relationship between HAART adherence and adipose tissue alterations. J Acquir Immune Defic Syndr. 2002;31(suppl 3):S140-S144.
PUBMED
73. Duran S. Save s M, Spire B, et al. Failure to maintain long-term adherence to highly active antiretroviral therapy: the role of lipodystrophy. AIDS. 2001;15(18):2441-2444.
PUBMED
74. Duran S, Spire B, Raffi B, et al.. Self-reported symptoms after initiation of a protease inhibitor in HIV-infected patients and their impact on adherence to HAART. HIV Clin Trials. 2001;2(1):38-45.
PUBMED
75. Green DR, Reed JC. Mitochondria and apoptosis. Science. 1998;281(5381):1309-1312.
FREE FULL TEXT
76. Saint-Marc T, Partisani M, Poizot-Martin I, et al.. Fat distribution evaluated by computed tomography and metabolic abnormalities in patients undergoing antiretroviral therapy: preliminary results of the LIPOCO study. AIDS. 2000;14(1):37-49.
PUBMED
77. Saint-Marc T, Touraine JL. The effects of discontinuing stavudine therapy on clinical and metabolic abnormalities in patients suffering from lipodystrophy. AIDS. 1999;13(15):2188-2189.
PUBMED
78. Cherry CL, Lal L, Thompson KA, et al.. Increased adipocyte apoptosis in lipoatrophy improves within 48 weeks of switching patient therapy from stavudine to abacavir or zidovudine. J Acquir Immune Defic Syndr. 2005;38(3):263-267.
PUBMED
79. McComsey GA, Ward DJ, Hessenthaler SM, et al.. Improvement in lipoatrophy associated with highly active antiretroviral therapy in human immunodeficiency virus-infected patients switched from stavudine to abacavir or zidovudine: the results of the TARHEEL study. Clin Infect Dis. 2004;38(2):263-270.
FREE FULL TEXT
80. Moyle G, Fisher M.; SWEET Study Group. Switching from Combivir to Truvada preserves limb fat: results of a DEXA sub-study of a 48-week randomized study. In: Program and abstracts of the 15th Conference on Retroviruses and Opportunistic Infections; February 3-6, 2008; Boston, MA. Abstract 938.81. Podzamczer D, Ferrer E, Sanchez P, et al.. Less lipoatrophy and better lipid profile with abacavir as compared to stavudine: 96-week results of a randomized study. J Acquir Immune Defic Syndr. 2007;44(2):139-147.
PUBMED
82. Saag MS, Cahn P, Raffi F, et al.. Efficacy and safety of emtricitabine vs stavudine in combination therapy in antiretroviral-naive patients: a randomized trial. JAMA. 2004;292(2):180-190.
FREE FULL TEXT
83. Gallant JE, Staszewski S, Pozniak AL, et al.. Efficacy and safety of tenofovir DF vs stavudine in combination therapy in antiretroviral-naïve patients: a 3-year randomized trial. JAMA. 2004;292(2):191-201.
FREE FULL TEXT
84. van Vonderen MGA, van Agtmael M, Hassink E, et al.. ZDV/3TC/LPV/r, but not NVP/LPV/r, is associated with limb fat loss and relative abdominal fat accumulation after 24 months in ART-naïve HIV-1-infected men: MEDICLAS, a randomized clinical trial. In: Program and abstracts of the 15th Conference on Retroviruses and Opportunistic Infections; February 3-6, 2008; Boston, MA. Abstract 937.85. Carr A, Hudson J, Chuah J, et al.. HIV protease inhibitor substitution in patients with lipodystrophy: a randomized, controlled, open-label multicentre study. AIDS. 2001;15(14):1811-1822.
PUBMED
86. Mart Tcell homeostasis following potent antiretroviral therapy: contribution to the development of human immunodeficiency virus-associated lipodystrophy syndrome. Blood. 2000;95(10):3191-3198.
FREE FULL TEXT
64. Lichtenstein KA, Delaney KM, Armon C, et al.. Incidence of and risk factors for lipoatrophy (abnormal fat loss) in ambulatory HIV-1-infected patients. J Acquir Immune Defic Syndr. 2003;32(1):48-56.
PUBMED
65. Kotler DP, Thea DM, Heo M, et al.. Relative influences of sex, race, environment, and HIV infection on body composition in adults. Am J Clin Nutr. 1999;69(3):432-439.
FREE FULL TEXT
66. Wanke C, Jacobsen D, Knox T, Gorbach S.. Prevalence of fat deposition and fat atrophy in a cohort of HIV-infected men and women. In: Program and abstracts of the 7th Conference on Retroviruses and Opportunistic Infections; January 30–February 4, 2000; San Francisco, CA. Abstract 24.67. Shevitz A, Wanke CA, Falutz J, Kotler DP. Clinical perspectives on HIVassociated lipodystrophy syndrome: an update. AIDS. 2001;15(15):1917-1930.
PUBMED
68. Lafaurie M, Dolivo M, Porcher R, et al.. Treatment of facial lipoatrophy with intradermal injections of polylactic acid in HIV-infected patients. J Acquir Immune Defic Syndr. 2005;38(4):393-398.
PUBMED
69. Khara M, Conway B.. Morphologic changes in HIV-infected men: sorting fact from fiction. J Acquir Immune Defic Syndr. 2005;40(2):119-120.
PUBMED
70. Dukers NH, Stolte IG, Albrecht N, et al.. The impact of experiencing lipodystrophy on the sexual behaviour and well-being among HIV-infected homosexual men. AIDS. 2001;15(6):812-813.
PUBMED
71. Collins E, Wagner C, Walmsley S.. Psychosocial impact of the lipodystrophy syndrome in HIV infection. AIDS Read. 2000;10(9):546-551.
PUBMED
72. Ammassari A, Antinori A, Cozzi-Lepri A, et al.. Relationship between HAART adherence and adipose tissue alterations. J Acquir Immune Defic Syndr. 2002;31(suppl 3):S140-S144.
PUBMED
73. Duran S. Save s M, Spire B, et al. Failure to maintain long-term adherence to highly active antiretroviral therapy: the role of lipodystrophy. AIDS. 2001;15(18):2441-2444.
PUBMED
74. Duran S, Spire B, Raffi B, et al.. Self-reported symptoms after initiation of a protease inhibitor in HIV-infected patients and their impact on adherence to HAART. HIV Clin Trials. 2001;2(1):38-45.
PUBMED
75. Green DR, Reed JC. Mitochondria and apoptosis. Science. 1998;281(5381):1309-1312.
FREE FULL TEXT
76. Saint-Marc T, Partisani M, Poizot-Martin I, et al.. Fat distribution evaluated by computed tomography and metabolic abnormalities in patients undergoing antiretroviral therapy: preliminary results of the LIPOCO study. AIDS. 2000;14(1):37-49.
PUBMED
77. Saint-Marc T, Touraine JL. The effects of discontinuing stavudine therapy on clinical and metabolic abnormalities in patients suffering from lipodystrophy. AIDS. 1999;13(15):2188-2189.
PUBMED
78. Cherry CL, Lal L, Thompson KA, et al.. Increased adipocyte apoptosis in lipoatrophy improves within 48 weeks of switching patient therapy from stavudine to abacavir or zidovudine. J Acquir Immune Defic Syndr. 2005;38(3):263-267.
PUBMED
79. McComsey GA, Ward DJ, Hessenthaler SM, et al.. Improvement in lipoatrophy associated with highly active antiretroviral therapy in human immunodeficiency virus-infected patients switched from stavudine to abacavir or zidovudine: the results of the TARHEEL study. Clin Infect Dis. 2004;38(2):263-270.
FREE FULL TEXT
80. Moyle G, Fisher M.; SWEET Study Group. Switching from Combivir to Truvada preserves limb fat: results of a DEXA sub-study of a 48-week randomized study. In: Program and abstracts of the 15th Conference on Retroviruses and Opportunistic Infections; February 3-6, 2008; Boston, MA. Abstract 938.81. Podzamczer D, Ferrer E, Sanchez P, et al.. Less lipoatrophy and better lipid profile with abacavir as compared to stavudine: 96-week results of a randomized study. J Acquir Immune Defic Syndr. 2007;44(2):139-147.
PUBMED
82. Saag MS, Cahn P, Raffi F, et al.. Efficacy and safety of emtricitabine vs stavudine in combination therapy in antiretroviral-naive patients: a randomized trial. JAMA. 2004;292(2):180-190.
FREE FULL TEXT
83. Gallant JE, Staszewski S, Pozniak AL, et al.. Efficacy and safety of tenofovir DF vs stavudine in combination therapy in antiretroviral-naïve patients: a 3-year randomized trial. JAMA. 2004;292(2):191-201.
FREE FULL TEXT
84. van Vonderen MGA, van Agtmael M, Hassink E, et al.. ZDV/3TC/LPV/r, but not NVP/LPV/r, is associated with limb fat loss and relative abdominal fat accumulation after 24 months in ART-naïve HIV-1-infected men: MEDICLAS, a randomized clinical trial. In: Program and abstracts of the 15th Conference on Retroviruses and Opportunistic Infections; February 3-6, 2008; Boston, MA. Abstract 937.85. Carr A, Hudson J, Chuah J, et al.. HIV protease inhibitor substitution in patients with lipodystrophy: a randomized, controlled, open-label multicentre study. AIDS. 2001;15(14):1811-1822.
PUBMED
86. Mart ’nez E. Garc ’nez E. Garc ’a-Viejo MA, Blanco JL, et al. Impact of switching from human immunodeficiency virus type 1 protease inhibitors to efavirenz in successfully treated adults with lipodystrophy. Clin Infect Dis. 2000;31(5):1266-1273.
PUBMED
87. Dunn CJ, Peters DH. Metformin: a review of its pharmacological properties and therapeutic use in non-insulin-dependent diabetes mellitus. Drugs. 1995;49(5):721-749.
PUBMED
88. Hadigan C, Corcoran C, Basgoz N, et al.. Metformin in the treatment of HIV lipodystrophy syndrome: a randomized clinical trial. JAMA. 2000;284(4):472-477.
FREE FULL TEXT
89. Mulligan K, Yang Y, Wininger DA, et al.. Effects of metformin and rosiglitazone in HIV-infected patients with hyperinsulinemia and elevated waist/hip ratio. AIDS. 2007;21(1):47-57.
PUBMED
90. Saint-Marc T, Touraine JL. Effects of metformin on insulin resistance and central adiposity in patients receiving effective protease inhibitor therapy. AIDS. 1999;13(8):1000-1002.
PUBMED
91. Kohli R, Shevitz A, Gorbach S, Wanke C.. A randomized placebo-controlled trial of metformin for the treatment of HIV lipodystrophy. HIV Med. 2007;8(7):420-426.
PUBMED
92. Worth L, Elliott J, Anderson J, et al.. A cautionary tale: fatal lactic acidosis complicating nucleoside analogue and metformin therapy. Clin Infect Dis. 2003;37(2):315-316.
FREE FULL TEXT
93. van Wijk JP, de Koning EJ, Cabezas MC, et al.. Comparison of rosiglitazone and metformin for treating HIV lipodystrophy: a randomized trial [published correction appears in Ann Intern Med. 2005;143(9):695]. Ann Intern Med. 2005;143(5):337-346.
FREE FULL TEXT
94. Hadigan C, Yawetz S, Thomas A, et al.. Metabolic effects of rosiglitazone in HIV lipodystrophy: a randomized, controlled trial. Ann Intern Med. 2004;140(10):786-794.
FREE FULL TEXT
95. Cavalcanti RB, Raboud J, Shen S, et al.. A randomized, placebo-controlled trial of rosiglitazone for HIV-related lipoatrophy. J Infect Dis. 2007;195(12):1754-1761.
FREE FULL TEXT
96. Nissen SE, Wolsky K. Effect of rosiglitazone on the risk of myocardial infarction and death from cardiovascular causes. N Engl J Med. 2007;356(24):2457-2471.
PUBMED
97. Grinspoon S.. Use of thiazolidinediones in HIV-infected patients: what have we learned? J Infect Dis. 2007;195(12):1731-1733.
FREE FULL TEXT
98. FDA approves drug for AIDS-wasting [press release]. August 23, 1996. http://www.fda.gov/bbs/topics/ANSWERS/ANS00756a.html. Accessed July 31, 2008.99. Grunfeld C, Thompson M, Brown SJ, et al.. Recombinant human growth hormone to treat HIV-associated adipose redistribution syndrome: 12-week induction and 24-week maintenance therapy. J Acquir Immune Defic Syndr. 2007;45(3):286-297.
PUBMED
100. Engelson ES, Glesby MJ, Mendez D, et al.. Effect of recombinant human growth hormone in the treatment of visceral fat accumulation in HIV infection. J Acquir Immune Defic Syndr. 2002;30(4):379-391.
PUBMED
101. Falutz J, Allas S, Blot K, et al.. Metabolic effects of a growth hormonereleasing factor in patients with HIV. N Engl J Med. 2007;357(23):2359-2370.
PUBMED
102. Falutz J, Allas S, Mamputu JC, et al.. Data on 52-week safety and efficacy of tesamorelin, a growth hormone-releasing factor analogue, in HIV-infected patients with abdominal fat accumulation. In: Program and abstracts of the 15th Conference on Retroviruses and Opportunistic Infections; February 3-6, 2008; Boston, MA. Abstract 943.103. DeWeese J, DeLaney A, Klein D, Horberg M.. Surgical treatment of HIV lipohypertrophy of head and neck. In: 10th Conference on Retroviruses and Opportunistic Infections (CROI); February 10-14, 2003; Boston, MA. Abstract 721.104. Piliero PJ, Hubbard M, King J, Faragon JJ. Use of ultrasonography-assisted liposuction for the treatment of human immunodeficiency virus-associated enlargement of the dorsocervical fat pad. Clin Infect Dis. 2003;37(10):1374-1377.
FREE FULL TEXT
105. Klein S, Fontana L, Young VL, et al.. Absence of an effect of liposuction on insulin action and risk factors for coronary heart disease. N Engl J Med. 2004;350(25):2549-2557.
PUBMED
106. Carey DL, Baker D, Rogers GD, et al.. A randomized, multicenter, open-label study of poly-L-lactic acid for HIV-1 facial lipoatrophy. J Acquir Immune Defic Syndr. 2007;46(5):581-589.
PUBMED
107. Valantin MA, Aubron-Olivier C, Ghosn J, et al.. Polylactic acid implants (New-Fill) to correct facial lipoatrophy in HIV-infected patients: results of the open-label study VEGA. AIDS. 2003;17(17):2471-2477.
PUBMED
108. Dockets Management FDA. Radiesse for soft tissue augmentation for the treatment of HIV-associated facial lipoatrophy. http://www.fda.gov/ohrms/dockets/ac/06/briefing/2006-4233b1_02.pdf. Accessed July 31, 2008.109. Mart ’a-Viejo MA, Blanco JL, et al. Impact of switching from human immunodeficiency virus type 1 protease inhibitors to efavirenz in successfully treated adults with lipodystrophy. Clin Infect Dis. 2000;31(5):1266-1273.
PUBMED
87. Dunn CJ, Peters DH. Metformin: a review of its pharmacological properties and therapeutic use in non-insulin-dependent diabetes mellitus. Drugs. 1995;49(5):721-749.
PUBMED
88. Hadigan C, Corcoran C, Basgoz N, et al.. Metformin in the treatment of HIV lipodystrophy syndrome: a randomized clinical trial. JAMA. 2000;284(4):472-477.
FREE FULL TEXT
89. Mulligan K, Yang Y, Wininger DA, et al.. Effects of metformin and rosiglitazone in HIV-infected patients with hyperinsulinemia and elevated waist/hip ratio. AIDS. 2007;21(1):47-57.
PUBMED
90. Saint-Marc T, Touraine JL. Effects of metformin on insulin resistance and central adiposity in patients receiving effective protease inhibitor therapy. AIDS. 1999;13(8):1000-1002.
PUBMED
91. Kohli R, Shevitz A, Gorbach S, Wanke C.. A randomized placebo-controlled trial of metformin for the treatment of HIV lipodystrophy. HIV Med. 2007;8(7):420-426.
PUBMED
92. Worth L, Elliott J, Anderson J, et al.. A cautionary tale: fatal lactic acidosis complicating nucleoside analogue and metformin therapy. Clin Infect Dis. 2003;37(2):315-316.
FREE FULL TEXT
93. van Wijk JP, de Koning EJ, Cabezas MC, et al.. Comparison of rosiglitazone and metformin for treating HIV lipodystrophy: a randomized trial [published correction appears in Ann Intern Med. 2005;143(9):695]. Ann Intern Med. 2005;143(5):337-346.
FREE FULL TEXT
94. Hadigan C, Yawetz S, Thomas A, et al.. Metabolic effects of rosiglitazone in HIV lipodystrophy: a randomized, controlled trial. Ann Intern Med. 2004;140(10):786-794.
FREE FULL TEXT
95. Cavalcanti RB, Raboud J, Shen S, et al.. A randomized, placebo-controlled trial of rosiglitazone for HIV-related lipoatrophy. J Infect Dis. 2007;195(12):1754-1761.
FREE FULL TEXT
96. Nissen SE, Wolsky K. Effect of rosiglitazone on the risk of myocardial infarction and death from cardiovascular causes. N Engl J Med. 2007;356(24):2457-2471.
PUBMED
97. Grinspoon S.. Use of thiazolidinediones in HIV-infected patients: what have we learned? J Infect Dis. 2007;195(12):1731-1733.
FREE FULL TEXT
98. FDA approves drug for AIDS-wasting [press release]. August 23, 1996. http://www.fda.gov/bbs/topics/ANSWERS/ANS00756a.html. Accessed July 31, 2008.99. Grunfeld C, Thompson M, Brown SJ, et al.. Recombinant human growth hormone to treat HIV-associated adipose redistribution syndrome: 12-week induction and 24-week maintenance therapy. J Acquir Immune Defic Syndr. 2007;45(3):286-297.
PUBMED
100. Engelson ES, Glesby MJ, Mendez D, et al.. Effect of recombinant human growth hormone in the treatment of visceral fat accumulation in HIV infection. J Acquir Immune Defic Syndr. 2002;30(4):379-391.
PUBMED
101. Falutz J, Allas S, Blot K, et al.. Metabolic effects of a growth hormonereleasing factor in patients with HIV. N Engl J Med. 2007;357(23):2359-2370.
PUBMED
102. Falutz J, Allas S, Mamputu JC, et al.. Data on 52-week safety and efficacy of tesamorelin, a growth hormone-releasing factor analogue, in HIV-infected patients with abdominal fat accumulation. In: Program and abstracts of the 15th Conference on Retroviruses and Opportunistic Infections; February 3-6, 2008; Boston, MA. Abstract 943.103. DeWeese J, DeLaney A, Klein D, Horberg M.. Surgical treatment of HIV lipohypertrophy of head and neck. In: 10th Conference on Retroviruses and Opportunistic Infections (CROI); February 10-14, 2003; Boston, MA. Abstract 721.104. Piliero PJ, Hubbard M, King J, Faragon JJ. Use of ultrasonography-assisted liposuction for the treatment of human immunodeficiency virus-associated enlargement of the dorsocervical fat pad. Clin Infect Dis. 2003;37(10):1374-1377.
FREE FULL TEXT
105. Klein S, Fontana L, Young VL, et al.. Absence of an effect of liposuction on insulin action and risk factors for coronary heart disease. N Engl J Med. 2004;350(25):2549-2557.
PUBMED
106. Carey DL, Baker D, Rogers GD, et al.. A randomized, multicenter, open-label study of poly-L-lactic acid for HIV-1 facial lipoatrophy. J Acquir Immune Defic Syndr. 2007;46(5):581-589.
PUBMED
107. Valantin MA, Aubron-Olivier C, Ghosn J, et al.. Polylactic acid implants (New-Fill) to correct facial lipoatrophy in HIV-infected patients: results of the open-label study VEGA. AIDS. 2003;17(17):2471-2477.
PUBMED
108. Dockets Management FDA. Radiesse for soft tissue augmentation for the treatment of HIV-associated facial lipoatrophy. http://www.fda.gov/ohrms/dockets/ac/06/briefing/2006-4233b1_02.pdf. Accessed July 31, 2008.109. Mart ’nez E, Conget I, Lozano L, et al.. Reversion of metabolic abnormalities after switching from HIV-1 protease inhibitors to nevirapine. AIDS. 1999;13(7):805-810.
PUBMED
110. Walli RK, Michl GM, Bogner JR, Gobel FD. Improvement of HAARTassociated insulin resistance and dyslipidemia after replacement of protease inhibitors with abacavir. Eur J Med Res. 2001;6(10):413-421.
PUBMED
111. American Diabetes Association. Standards ofmedical care in diabetes—2007. Diabetes Care. 2007;30(suppl 1):S4-S41.
FREE FULL TEXT
112. Hadigan C, Meigs JB, Corcoran C, et al.. Metabolic abnormalities and cardiovascular disease risk factors in adults with human immunodeficiency virus infection and lipodystrophy. Clin Infect Dis. 2001;32(1):130-139.
FREE FULL TEXT
113. Tominaga M, Igarashi K, Eguchi H, et al.. Impaired glucose tolerance is a risk factor for cardiovascular disease, but not impaired fasting glucose. Diabetes Care. 1999;22(6):920-924.
ABSTRACT
114. Echevarria KL, Hardin TC, Smith JA. Hyperlipidemia associated with protease inhibitor therapy. Ann Pharmacother. 1999;33(7-8):859-863.
ABSTRACT
115. Piliero P, Cahn P, Pantaleo G, et al.. Atazanavir: a once-daily protease inhibitor with a superior lipid profile: results of clinical trials beyond week 48. In: Program and abstracts of the 9th Conference on Retroviruses and Opportunistic Infections; February 24-28, 2002; Seattle, WA. Abstract 706-T.116. Friis-Møller N, Reiss P, Sabin CA.; DAD Study Group. Class of antiretroviral drugs and the risk of myocardial infarction. N Engl J Med. 2007;356(17):1723-1735.
PUBMED
117. Sabin C, Worm S, Weber R, et al.. Do thymidine analogues, abacavir, didanosine and lamivudine contribute to the risk of myocardial infarction? the DAD Study. In: Program and abstracts of the 15th Conference on Retroviruses and Opportunistic Infections, February 3-6, 2008; Boston, MA. Abstract 957c.118. National Cholesterol Education Program Expert Panel on Detection, Evaluation and Treatment of High Blood Cholesterol in Adults.. Detection, Evaluation and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). Rockville, MD: National Heart, Lung, and Blood Institute, National Institutes of Health; 2002.119. Gerber JG, Rosenkranz SL, Fichtenbaum CJ, et al.. Effect of efavirenz on the pharmacokinetics of simvastatin, atorvastatin, and pravastatin: results of AIDS Clinical Trials Group 5108 Study. J Acquir Immune Defic Syndr. 2005;39(3):307-312.
PUBMED
120. Smith BA, Neidig JL, Nickel JT, et al.. Aerobic exercise: effects on parameters related to fatigue, dyspnea, weight and body composition in HIV-infected adults. AIDS. 2001;15(6):693-701.
PUBMED
121. Jones SP, Doran DA, Leatt PB, et al.. Short-term exercise training improves body composition and hyperlipidaemia inHIV-positive individualswith lipodystrophy. AIDS. 2001;15(15):2049-2051.
PUBMED
122. Driscoll SD, Meininger GE, Lareau MT, et al.. Effects of exercise training and metformin on body composition and cardiovascular indices in HIV-infected patients. AIDS. 2004;18(3):465-473.
PUBMED
123. Mun D, Engelson E, Albu J, et al.. Effects of diet and exercise and rosiglitazone on body composition and lipids, including oxidized LDL in HIV ’nez E, Conget I, Lozano L, et al.. Reversion of metabolic abnormalities after switching from HIV-1 protease inhibitors to nevirapine. AIDS. 1999;13(7):805-810.
PUBMED
110. Walli RK, Michl GM, Bogner JR, Gobel FD. Improvement of HAARTassociated insulin resistance and dyslipidemia after replacement of protease inhibitors with abacavir. Eur J Med Res. 2001;6(10):413-421.
PUBMED
111. American Diabetes Association. Standards ofmedical care in diabetes—2007. Diabetes Care. 2007;30(suppl 1):S4-S41.
FREE FULL TEXT
112. Hadigan C, Meigs JB, Corcoran C, et al.. Metabolic abnormalities and cardiovascular disease risk factors in adults with human immunodeficiency virus infection and lipodystrophy. Clin Infect Dis. 2001;32(1):130-139.
FREE FULL TEXT
113. Tominaga M, Igarashi K, Eguchi H, et al.. Impaired glucose tolerance is a risk factor for cardiovascular disease, but not impaired fasting glucose. Diabetes Care. 1999;22(6):920-924.
ABSTRACT
114. Echevarria KL, Hardin TC, Smith JA. Hyperlipidemia associated with protease inhibitor therapy. Ann Pharmacother. 1999;33(7-8):859-863.
ABSTRACT
115. Piliero P, Cahn P, Pantaleo G, et al.. Atazanavir: a once-daily protease inhibitor with a superior lipid profile: results of clinical trials beyond week 48. In: Program and abstracts of the 9th Conference on Retroviruses and Opportunistic Infections; February 24-28, 2002; Seattle, WA. Abstract 706-T.116. Friis-Møller N, Reiss P, Sabin CA.; DAD Study Group. Class of antiretroviral drugs and the risk of myocardial infarction. N Engl J Med. 2007;356(17):1723-1735.
PUBMED
117. Sabin C, Worm S, Weber R, et al.. Do thymidine analogues, abacavir, didanosine and lamivudine contribute to the risk of myocardial infarction? the DAD Study. In: Program and abstracts of the 15th Conference on Retroviruses and Opportunistic Infections, February 3-6, 2008; Boston, MA. Abstract 957c.118. National Cholesterol Education Program Expert Panel on Detection, Evaluation and Treatment of High Blood Cholesterol in Adults.. Detection, Evaluation and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). Rockville, MD: National Heart, Lung, and Blood Institute, National Institutes of Health; 2002.119. Gerber JG, Rosenkranz SL, Fichtenbaum CJ, et al.. Effect of efavirenz on the pharmacokinetics of simvastatin, atorvastatin, and pravastatin: results of AIDS Clinical Trials Group 5108 Study. J Acquir Immune Defic Syndr. 2005;39(3):307-312.
PUBMED
120. Smith BA, Neidig JL, Nickel JT, et al.. Aerobic exercise: effects on parameters related to fatigue, dyspnea, weight and body composition in HIV-infected adults. AIDS. 2001;15(6):693-701.
PUBMED
121. Jones SP, Doran DA, Leatt PB, et al.. Short-term exercise training improves body composition and hyperlipidaemia inHIV-positive individualswith lipodystrophy. AIDS. 2001;15(15):2049-2051.
PUBMED
122. Driscoll SD, Meininger GE, Lareau MT, et al.. Effects of exercise training and metformin on body composition and cardiovascular indices in HIV-infected patients. AIDS. 2004;18(3):465-473.
PUBMED
123. Mun D, Engelson E, Albu J, et al.. Effects of diet and exercise and rosiglitazone on body composition and lipids, including oxidized LDL in HIV and HIV- men and women. In: Program and abstracts of the 15th Conference on Retroviruses and Opportunistic Infections; February 3-6, 2008; Boston, MA. Abstract 944.124. Hendricks KM, Dong KR, Tang AM, et al.. High-fiber diet in HIV-positive men is associated with lower risk of developing fat deposition. Am J Clin Nutr. 2003;78(4):790-795.
FREE FULL TEXT
125. Joy T, Keogh HM, Hadigan C, et al.. Dietary fat intake and relationship to serum lipid levels in HIV-infected patients with metabolic abnormalities in the HAART era. AIDS. 2007;21(12):1591-1600.
PUBMED
126. Aghdassi E, Salit I, Mohammed S, et al.. Chromium supplementation decreases insulin resistance and trunk fat. In: Program and abstracts of the 15th Conference on Retroviruses and Opportunistic Infections; February 3-6, 2008; Boston, MA. Abstract 936.127. El-Sadr WM, Lundgren JD, Neaton JD.; Strategies for Management of Antiretroviral Therapy (SMART) Study Group. CD4 and HIV- men and women. In: Program and abstracts of the 15th Conference on Retroviruses and Opportunistic Infections; February 3-6, 2008; Boston, MA. Abstract 944.124. Hendricks KM, Dong KR, Tang AM, et al.. High-fiber diet in HIV-positive men is associated with lower risk of developing fat deposition. Am J Clin Nutr. 2003;78(4):790-795.
FREE FULL TEXT
125. Joy T, Keogh HM, Hadigan C, et al.. Dietary fat intake and relationship to serum lipid levels in HIV-infected patients with metabolic abnormalities in the HAART era. AIDS. 2007;21(12):1591-1600.
PUBMED
126. Aghdassi E, Salit I, Mohammed S, et al.. Chromium supplementation decreases insulin resistance and trunk fat. In: Program and abstracts of the 15th Conference on Retroviruses and Opportunistic Infections; February 3-6, 2008; Boston, MA. Abstract 936.127. El-Sadr WM, Lundgren JD, Neaton JD.; Strategies for Management of Antiretroviral Therapy (SMART) Study Group. CD4 count-guided interruption of antiretroviral treatment. N Engl J Med. 2006;355(22):2283-2296.
PUBMED
128. Rodriguez-Novoa S, Barreiro P. Rendó n A, et al. Influence of 516G count-guided interruption of antiretroviral treatment. N Engl J Med. 2006;355(22):2283-2296.
PUBMED
128. Rodriguez-Novoa S, Barreiro P. Rendó n A, et al. Influence of 516G T polymorphisms at the gene encoding the CYP450-2B6 isoenzyme on efavirenz plasma concentrations in HIV-infected subjects. Clin Infect Dis. 2005;40(9):1358-1361.
FREE FULL TEXT
129. Haas DW, Ribaudo HJ, Kim RB, et al.. Pharmacogenetics of efavirenz and central nervous system side effects: an Adult AIDS Clinical Trials Group study. AIDS. 2004;18(18):2391-2400.
PUBMED T polymorphisms at the gene encoding the CYP450-2B6 isoenzyme on efavirenz plasma concentrations in HIV-infected subjects. Clin Infect Dis. 2005;40(9):1358-1361.
FREE FULL TEXT
129. Haas DW, Ribaudo HJ, Kim RB, et al.. Pharmacogenetics of efavirenz and central nervous system side effects: an Adult AIDS Clinical Trials Group study. AIDS. 2004;18(18):2391-2400.
PUBMED
ARTICLE EN RAPPORT
Cette semaine dans le JAMA-Français
JAMA. 2008;300:995.
Texte Complet
|