 |
 |

JAMA EXPRESS
Varenicline, agoniste partiel des récepteurs nicotiniques à l'acétylcholine de type 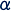 4β2, versus bupropion à libération prolongée et placebo dans l'arrêt du tabac 4β2, versus bupropion à libération prolongée et placebo dans l'arrêt du tabacUn essai contrôlé randomisé
David Gonzales, PhD;
Stephen I. Rennard, MD;
Mitchell Nides, PhD;
Cheryl Oncken, MD;
Salomon Azoulay, MD;
Clare B. Billing, MS;
Eric J. Watsky, MD;
Jason Gong, MD;
Kathryn E. Williams, PhD;
Karen R. Reeves, MD
RÉSUMÉ
 |  |
Contexte Les récepteurs nicotiniques à
l'acétylcholine (nAChR) de type  4β2 sont associés
aux effets renforçants de la nicotine et au maintien du comportement
tabagique. La varenicline, un nouvel agoniste partiel des récepteurs 4β2 sont associés
aux effets renforçants de la nicotine et au maintien du comportement
tabagique. La varenicline, un nouvel agoniste partiel des récepteurs
 4β2, pourrait avoir un effet favorable dans la
désintoxication tabagique. 4β2, pourrait avoir un effet favorable dans la
désintoxication tabagique.
Objectif Évaluer l'efficacité et l'innocuité de
la varenicline dans l'arrêt du tabac, par rapport au bupropion à
libération prolongée (bupropion LP) et à un placebo.
Schéma, cadre et participants Essai clinique de phase 3
randomisé en double aveugle, en groupes parallèles, contre
placebo et traitement actif, mené dans 19 centres américains, du
19 juin 2003 au 22 avril 2005. Les participants étaient 1 025 fumeurs
généralement sains ( 10 cigarettes/j) avec moins de 3 mois
d'abstinence tabagique dans l'année passée; ils étaient
âgés de 18 à 75 ans et ont été
recrutés par publicité. 10 cigarettes/j) avec moins de 3 mois
d'abstinence tabagique dans l'année passée; ils étaient
âgés de 18 à 75 ans et ont été
recrutés par publicité.
Intervention Les participants ont été
randomisés au rapport 1:1:1 pour recevoir une brève consultation
d'aide et de la varenicline à la dose de 1 mg deux fois par jour (n =
352), du bupropion LP à la dose de 150 mg deux fois par jour (n = 329),
ou un placebo (n = 344), administrés par voie orale pendant 12
semaines. Ils ont ensuite effectué 40 semaines de suivi sans
traitement.
Principaux critères d'évaluation Le principal
critère d'évaluation était le taux d'abstinence tabagique
continue de 4 semaines confirmée par la mesure du monoxyde de carbone
expiré, des semaines 9 à 12. Les critères secondaires
d'évaluation incluaient les taux d'abstinence continue des semaines 9
à 24 et des semaines 9 à 52.
Résultats Des semaines 9 à 12, les taux d'abstinence
continue de 4 semaines étaient de 44,0 % pour la varenicline
versus 17,7 % pour le placebo (odds ratio [OR], 3,85; intervalle de
confiance [IC] à 95 %, 2,70-5,50; p < 0,001) et
versus 29,5 % pour le bupropion LP (OR, 1,93; IC 95 %, 1,40-2,68;
p < 0,001). Le bupropion LP était également
significativement plus efficace que le placebo (OR, 2,00; IC 95 %, 1,38-2,89;
p < 0,001). Pendant les semaines 9 à 52, les taux
d'abstinence continue étaient de 21,9 % pour la varenicline
versus 8,4 % pour le placebo (OR, 3,09; IC 95 %, 1,95-4,91;
p < 0,001) et versus 16,1 % pour le bupropion LP (OR, 1,46; IC 95
%, 0,99-2,17; p = 0,057). La varenicline réduisait le besoin
compulsif et le syndrome de manque et, chez ceux qui fumaient tout en recevant
le traitement, la satisfaction procurée par le tabac. Aucune
différence en termes de sexe n'a été observée dans
l'efficacité de la varenicline. La varenicline était sans danger
et généralement bien tolérée, avec des taux
d'arrêt de traitement comparables à ceux du placebo. Les
événements indésirables les plus fréquents chez
les participants recevant un traitement actif étaient les
nausées (98 participants sous varenicline [28,1 %]) et l'insomnie (72
participants sous bupropion LP [21,9 %]).
Conclusion La varenicline était significativement plus
efficace que le placebo dans l'arrêt du tabac à tous les temps
d'évaluation, et significativement plus efficace que le bupropion LP
après 12 semaines de traitement, ainsi qu'à 24 semaines.
Trial Registration
clinicaltrials.gov
Identifier: NCT00141206.
JAMA. 2006 ; 296 :
47-55.
Bien que près de 41 % des fumeurs tentent d'arrêter
chaque année, ils rechutent fréquemment, et environ 10 %
seulement parviennent à rester
abstinents.1 Les
effets négatifs du sevrage nicotinique sont en partie responsables de
ces faibles taux de
succès.2,3
Les pharmacothérapies approuvées dans le traitement de la
dépendance à la nicotine (substituts nicotiniques et bupropion
par exemple) ont démontré une efficacité certaine, bien
que modérée, avec des taux d'arrêt globalement deux fois
supérieurs à ceux d'un
placebo.4 De
nouveaux traitements plus efficaces sont donc nécessaires.
Des données récentes soutiennent un rôle primordial du
sous-type  4β2 des récepteurs nicotiniques à
l'acétylcholine (nAChR) dans les effets renforçants de la
nicotine, évalué par le renouvellement et la libération
de dopamine dans le noyau
accumbens.5-8
Il a été suggéré que les agonistes partiels des
récepteurs 4β2 des récepteurs nicotiniques à
l'acétylcholine (nAChR) dans les effets renforçants de la
nicotine, évalué par le renouvellement et la libération
de dopamine dans le noyau
accumbens.5-8
Il a été suggéré que les agonistes partiels des
récepteurs  4β2 pouvaient constituer des aides au sevrage
tabagique plus efficaces que les traitements actuellement disponibles. Les
agonistes partiels aux nAChR pourraient stimuler une libération de
dopamine suffisante pour réduire le désir compulsif et le
manque, tout en agissant simultanément comme un antagoniste partiel en
bloquant la liaison et les effets renforçants subséquents de la
nicotine absorbée. Les propriétés d'agoniste partiel des
récepteurs 4β2 pouvaient constituer des aides au sevrage
tabagique plus efficaces que les traitements actuellement disponibles. Les
agonistes partiels aux nAChR pourraient stimuler une libération de
dopamine suffisante pour réduire le désir compulsif et le
manque, tout en agissant simultanément comme un antagoniste partiel en
bloquant la liaison et les effets renforçants subséquents de la
nicotine absorbée. Les propriétés d'agoniste partiel des
récepteurs  4β2 rapportées pour la cytisine,
alcaloïde végétal naturel, ont fourni un point de
départ structural au développement de la varenicline, agoniste
partiel des récepteurs 4β2 rapportées pour la cytisine,
alcaloïde végétal naturel, ont fourni un point de
départ structural au développement de la varenicline, agoniste
partiel des récepteurs  4β2 de haute affinité non
nicotinique,9-11
spécifiquement étudiée pour l'arrêt du tabac. Dans
les études animales, l'effet agoniste de la varenicline sur la
libération de dopamine représentait 35 % à 60 % de la
réponse nicotinique
maximale.11 4β2 de haute affinité non
nicotinique,9-11
spécifiquement étudiée pour l'arrêt du tabac. Dans
les études animales, l'effet agoniste de la varenicline sur la
libération de dopamine représentait 35 % à 60 % de la
réponse nicotinique
maximale.11
La présente étude de phase 3 évaluait
l'efficacité de la varenicline comparée à un placebo et
au bupropion à libération prolongée (bupropion LP) chez
des fumeurs adultes généralement sains. Deux études avec
un schéma identique ont été menées dans des
centres différents. Les résultats de l'une d'elles sont
rapportés ici. Ceux de l'autre étude font l'objet d'un autre
article de ce numéro du
JAMA.12
MÉTHODES
Schéma de l'étude
Cette étude était un essai clinique de phase 3
randomisé, multicentrique, en double aveugle, en groupes
parallèles, contre placebo et traitement actif, avec une phase de
traitement de 12 semaines et un suivi postétude en aveugle
jusqu'à la semaine 52. L'étude était menée
conformément aux principes de la Déclaration d'Helsinki et aux
Bonnes pratiques cliniques de l'ICH (Conférence internationale sur
l'harmonisation), dans 19 centres des États-Unis, du 19 juin 2003 au 22
avril 2005. Le comité d'éthique de chaque centre a
approuvé le protocole de l'étude, et tous les participants ont
donné leur consentement éclairé écrit avant toute
procédure.
Population de l'étude
Les participants ont été recrutés par publicité
dans les médias. Les personnes éligibles étaient
âgées de 18 à 75 ans, fumaient 10 cigarettes ou plus par
jour, avaient expérimenté moins de 3 mois d'abstinence tabagique
dans l'année passée, et étaient motivées pour
arrêter de fumer. Les critères d'exclusion étaient une
maladie grave ou instable dans les 6 mois; un risque de crise
d'épilepsie; un diabète non insulinodépendant
nécessitant une insulinothérapie ou un traitement
hypoglycémiant oral; une insuffisance hépatique ou
rénale; une maladie cardiovasculaire cliniquement significative dans
les 6 mois; une hypertension non contrôlée; une
broncho-pneumopathie chronique obstructive grave; une histoire de cancer
(à l'exception de l'épithélioma baso-cellulaire ou
malpighien spino-cellulaire de la peau traité); et des
antécédents de réactions allergiques cliniquement
significatives. Les autres critères d'exclusion étaient une
dépression majeure au cours de l'année passée
nécessitant un traitement; un antécédent de trouble
panique, de psychose, de trouble bipolaire, de troubles du comportement
alimentaire; un abus/dépendance d'alcool ou de substances au cours de
l'année passée; l'usage de produits tabagiques autres que la
cigarette; l'usage de substituts nicotiniques, de clonidine ou de
nortriptyline dans le mois précédant l'inclusion; et un indice
de masse corporelle (calculé par le poids en kilogrammes divisé
par le carré de la taille en mètres) inférieur à
15 ou supérieur à 38, ou un poids corporel inférieur
à 45,5 kg.
L'efficacité du bupropion étant réduite chez les
individus précédemment exposés à la substance
comparé aux sujets
naïfs,13 les
participants ayant déjà été traités par
bupropion étaient exclus. Ceux ayant été
précédemment exposés à la varenicline
étaient également exclus. Les femmes en âge de
procréer étaient éligibles si elles n'étaient pas
en période de grossesse ou d'allaitement et utilisaient un moyen de
contraception efficace (contraceptifs oraux, injectables, ou implants;
stérilet; ou méthode de barrière comme les
spermicides).
Interventions
Une séquence de randomisation prédéfinie,
générée centralement par ordinateur, assignait les
participants au rapport 1:1:1 à recevoir de la varenicline, du
bupropion LP, ou un placebo, avec une taille de bloc de 6 et une
stratification par centre. Les participants étaient randomisés
pour recevoir un traitement actif ou un placebo correspondant,
administré par voie orale pendant 12 semaines. Les traitements actifs
étaient titrés de la manière suivante: varenicline 0,5
mg/j pendant les jours 1 à 3, 0,5 mg deux fois par jour des jours 4
à 7, puis 1 mg deux fois par jour jusqu'à la semaine 12;
bupropion LP, 150 mg/j des jours 1 à 3, puis 150 mg deux fois par jour
jusqu'à la semaine 12. Les participants et les investigateurs
étaient aveugles aux attributions de traitement. Il était
demandé aux participants de ne pas tenter de connaître leur
traitement; il leur était en outre recommandé de manger avant
les prises et d'espacer les doses d'au moins 8 heures.
Tous les participants recevaient le traitement de l'étude à
la visite initiale (randomisation), ainsi qu'une brochure d'aide à
l'arrêt du tabac (Clearing the Air: Quit Smoking
Today),14
destinée à les guider dans le processus de sevrage; il leur
était également recommandé de prendre leur
première dose le jour suivant. La date d'arrêt était
fixée au 8ème jour (visite à 1 semaine). Une
consultation de suivi par téléphone était
effectuée 3 jours suivant la date d'arrêt fixée. Les
participants n'étaient ni pressés ni découragés de
faire une tentative d'arrêt avant la date fixée. Pendant la phase
de traitement de 12 semaines, les participants assistaient à des
consultations de suivi hebdomadaires destinées à évaluer
leur statut tabagique, leur observance du traitement, et leur
tolérance. De brèves ( 10 minutes) consultations
standardisées individuelles étaient dispensées pour les
aider à résoudre d'éventuels problèmes et à
renforcer leurs aptitudes dans la prévention des rechutes,
conformément aux recommandations cliniques publiées par les
autorités de santé
américaines.15
Les personnes arrêtant prématurément le traitement
étaient encouragées à rester dans l'étude,
à assister aux visites de suivi restantes et à terminer toutes
les évaluations. 10 minutes) consultations
standardisées individuelles étaient dispensées pour les
aider à résoudre d'éventuels problèmes et à
renforcer leurs aptitudes dans la prévention des rechutes,
conformément aux recommandations cliniques publiées par les
autorités de santé
américaines.15
Les personnes arrêtant prématurément le traitement
étaient encouragées à rester dans l'étude,
à assister aux visites de suivi restantes et à terminer toutes
les évaluations.
Les participants achevant la période de traitement de 12 semaines
enchaînaient une phase de suivi post-traitement sans médicament,
des semaines 13 à 52. Les consultations de suivi étaient
prévues pour les semaines 13, 24, 36, 44 et 52, avec des
évaluations téléphoniques aux semaines 16, 20, 28, 32, 40
et 48. Lors des visites, l'usage de produits tabagiques ou de traitements pour
l'arrêt du tabac depuis la précédente consultation
était évalué, et de brèves consultations d'aide
à l'arrêt du tabac étaient dispensées.
Sélection
La visite de sélection incluait un bilan médical,
l'autodéclaration de la race (caucasien, blanc, asiatique ou autre), un
bref examen physique, un électrocardiogramme, et la mesure des signes
vitaux (tension artérielle, rythme cardiaque au repos et poids
corporel). Les analyses biologiques comprenaient une numération
globulaire complète, une chimie sanguine et un examen des urines
(bandelette réactive). L'histoire tabagique était recueillie et
le test de
Fagerström16
était administré.
Post-randomisation
Les signes vitaux étaient mesurés à chaque visite de
suivi. Les électrocardiogrammes, les analyses sanguines et les examens
d'urine étaient répétés aux semaines 2 et 12 ou
à l'arrêt du traitement. Un examen physique était
effectué à la semaine 12 ou à l'arrêt
prématuré du traitement.
Statut tabagique
L'autodéclaration de non tabagisme et une mesure du monoxyde de
carbone expiré de moins de 10 particules par million (ppm),
critère standard d'évaluation de l'absence de tabagisme
utilisé dans les études du sevrage
tabagique,13,17
était effectuées à l'inclusion et à chaque visite
de suivi pour confirmer le statut tabagique. Un inventaire de l'usage de
nicotine était administré aux consultations effectuées
par téléphone et sur site pour évaluer le tabagisme
auto-rapporté (même une bouffée) ou l'usage d'autres
produits nicotiniques ou tabagiques depuis le précédent contact,
ainsi que durant les 7 derniers jours.
Critères d'évaluation
Le critère primaire d'évaluation était le taux
d'abstinence continue de 4 semaines confirmée par le monoxyde de
carbone expiré, des semaines 9 à 12, défini par la
proportion de participants ayant rapporté l'absence de tabagisme (pas
même une bouffée) ou d'usage de produits contenant de la
nicotine, confirmée par une mesure du monoxyde de carbone expiré
inférieure ou égale à 10 ppm. Le critère des 4
dernières semaines de traitement était basé sur le
précédent utilisé dans les études
antérieures sur l'arrêt du
tabac.13,18
Les deux critères secondaires étaient les taux d'abstinence
continue de la semaine 9 à la semaine 24, et de la semaine 9 à
la semaine 52. Ces taux étaient définis comme la proportion de
participants répondant aux critères d'abstinence des semaines 9
à 12 et rapportant l'absence de tabagisme ou d'usage de produits
tabagiques aux consultations par téléphone ou sur site
jusqu'à la semaine 24 et séparément jusqu'à la
semaine 52, avec confirmation par une mesure du monoxyde de carbone
expiré inférieure ou égale à 10 ppm aux visites
sur place seulement.
Les autres critères secondaires étaient la prévalence
exprimée en pourcentage des taux d'abstinence de 7 jours aux semaines
12, 24 et 52. Le taux de prévalence d'abstinence de 7 jours
était défini par la proportion de participants ayant
répondu aux critères d'abstinence pour les 7 jours
précédant chaque visite (vérifié par la mesure du
monoxyde de carbone expiré à chaque visite au centre). La
variation moyenne du poids corporel entre l'inclusion et la semaine 12
était regroupée pour tous les participants ayant achevé
la période de traitement, et séparée pour ceux
restés abstinents de la semaine 9 à la semaine 12.
Mesures du désir compulsif, du manque et des effets renforçants du tabac
Trois instruments étaient utilisés pour évaluer les
critères liés au désir compulsif, au manque et aux effets
renforçants du tabac. L'échelle MNWS (Minnesota Nicotine
Withdrawal
Scale)19,20
était administrée à l'inclusion et aux semaines 1
à 7, puis aux semaines 12 et 13. L'échelle MNWS évalue
l'envie compulsive de fumer, l'humeur dépressive,
l'irritabilité, l'anxiété, la difficulté à
se concentrer, l'agitation, l'augmentation de l'appétit, et le sommeil.
Le questionnaire QSU-brief (Brief Questionnaire of Smoking
Urges)21,22
était administré à l'inclusion et aux semaines 1 à
7, puis à la semaine 12, pour évaluer le besoin compulsif
lié au désir de fumer et les attentes des effets positifs. Le
questionnaire mCEQ (Modified Cigarette Evaluation Questionnaire),
utilisé pour évaluer les effets renforçants du
tabac,23-25
était auto administré par tous les participants à
l'inclusion, puis quotidiennement pendant la première semaine de
traitement (avant la date d'arrêt fixée), et par la suite, aux
visites des semaines 1 à 7, seulement par ceux qui avaient fumé
depuis la dernière fois qu'ils avaient rempli le questionnaire.
Événements indésirables
Tous les événements indésirables observés ou
auto-rapportés étaient déclarés dans des
formulaires de notification et suivis jusqu'à leur résolution ou
à la fin de l'étude. Les événements
indésirables, indépendamment de la dose, ayant
entraîné le décès, menacé le pronostic
vital, requis une hospitalisation ou la prolongation d'une hospitalisation en
cours, ayant entraîné une invalidité ou une
incapacité persistante ou significative, ou induit une anomalie ou une
malformation congénitale, étaient classifiés comme
événements indésirables graves, déclarés
dans des formulaires de notification et rapportés au promoteur.
Analyse statistique
Les données d'efficacité et les comparaisons en intention de
traiter sont rapportées pour tous les participants randomisés.
Une taille d'échantillon de 335335 participants par groupe était
estimée comme fournissant une puissance de 90 % pour un test
 2 bilatéral avec 2 bilatéral avec  = 0,05, pour la comparaison
entre la varenicline et le bupropion LP pour le taux d'abstinence continue de
4 semaines basé sur un odds ratio (OR) de 1,72 versus un taux
de réponse au bupropion LP de 28,6
%.26 = 0,05, pour la comparaison
entre la varenicline et le bupropion LP pour le taux d'abstinence continue de
4 semaines basé sur un odds ratio (OR) de 1,72 versus un taux
de réponse au bupropion LP de 28,6
%.26
Les participants ayant manqué des visites de suivi étaient
considérés comme abstinents si, à la visite suivante, ils
rapportaient n'avoir pas fumé ni consommé de produits
nicotiniques ou tabagiques depuis la précédente consultation de
suivi. Ceux ayant une donnée de monoxyde de carbone manquante, mais
répondant à l'autre critère d'abstinence, étaient
considérés comme non-fumeurs avant la semaine 52. À la
semaine 52, seuls les participants assistant à la consultation et
répondant à tous les critères étaient
considérés comme abstinents. Les participants qui se sont
retirés prématurément de l'étude étaient
considérés comme fumeurs.
Les valeurs de prévalence exprimée en pourcentage
d'abstinence de 7 jours étaient évaluées
indépendamment à chaque consultation de suivi
téléphonique ou sur site. Les participants ayant manqué
des visites étaient considérés comme fumeurs pour cette
période de 7 jours. Les valeurs manquantes de monoxyde de carbone
étaient traitées comme décrit ci-avant.
Les taux d'abstinence continue pour les semaines 9 à 12
(confirmée par mesure du monoxyde de carbone) et pour les semaines 9
à 52 (confirmée par mesure du monoxyde de carbone lors des
visites aux centres) étaient analysés selon la randomisation,
à l'aide d'un modèle de régression logistique incluant le
traitement et le centre; un test  2 de rapport de vraisemblance
était effectué. Pour ces analyses, une méthode de
régression était utilisée pour préserver un risque
alpha égal à 5 % pour les 2 comparaisons de la varenicline.
L'ordre des comparaisons était le suivant: varenicline versus
placebo suivie de varenicline versus bupropion LP. Tous les tests de
significativité étaient bilatéraux avec un seuil de
significativité global de 2 de rapport de vraisemblance
était effectué. Pour ces analyses, une méthode de
régression était utilisée pour préserver un risque
alpha égal à 5 % pour les 2 comparaisons de la varenicline.
L'ordre des comparaisons était le suivant: varenicline versus
placebo suivie de varenicline versus bupropion LP. Tous les tests de
significativité étaient bilatéraux avec un seuil de
significativité global de  = 0,05. Les odds ratios et les
intervalles de confiance (IC) à 95 % présentés sont des
estimations du modèle de régression logistique,
rapportées pour chaque comparaison de traitement. Les comparaisons de
traitement pour la prévalence d'abstinence de 7 jours étaient
effectuées aux semaines 12, 24 et 52, à l'aide du modèle
de régression logistique. Après analyse clinique, les
résultats biologiques et les autres données de tolérance
ont été regroupés par fréquence
d'événement et variation moyenne par rapport à
l'inclusion. = 0,05. Les odds ratios et les
intervalles de confiance (IC) à 95 % présentés sont des
estimations du modèle de régression logistique,
rapportées pour chaque comparaison de traitement. Les comparaisons de
traitement pour la prévalence d'abstinence de 7 jours étaient
effectuées aux semaines 12, 24 et 52, à l'aide du modèle
de régression logistique. Après analyse clinique, les
résultats biologiques et les autres données de tolérance
ont été regroupés par fréquence
d'événement et variation moyenne par rapport à
l'inclusion.
|
|

|
|
Figure 1.. Organigramme de l'étude.
|
|
|
Les résultats de chaque sous-échelle du MNWS, du
QSU-brief, et du mCEQ étaient analysés en variables
continues à partir des données recueillies à chaque
visite de suivi hebdomadaire pendant les 7 premières semaines de
traitement. L'analyse était basée sur un modèle à
mesures répétées, avec le traitement, la mesure initiale,
le centre, la visite et l'interaction traitement/visite en facteurs. Les
estimations du modèle sur l'effet moyen et les valeurs de p
étaient obtenues en comparant la moyenne de la semaine 1 à la
semaine 7. Le logiciel SAS (SAS Institute Inc, Cary, Caroline du Nord) version
8.2 a été utilisé pour toutes les analyses.
RÉSULTATS
Organigramme des participants
Sur les 1 483 participants sélectionnés, 1 025 étaient
éligibles; ils ont été randomisés pour recevoir un
traitement et inclus dans l'analyse
(Figure 1). Les taux
d'achèvement de l'étude de 52 semaines étaient de 60,5 %
(213/352) pour la varenicline, de 56 % (184/329) pour le bupropion LP, et de
54 % (187/344) pour le placebo. La plupart des sorties d'étude ont eu
lieu pendant la phase de traitement. Les perdus de vue constituaient la
majorité des sorties d'étude pendant les deux périodes de
suivi, sous traitement et post-traitement. L'observance du traitement
était comparable entre tous les groupes, avec une durée
médiane de traitement de 84 jours dans chacun des 3 groupes.
Les caractéristiques initiales et démographiques
étaient similaires entre les groupes
(Tableau 1).
Globalement, 54 % des participants étaient de sexe masculin et 79 %
étaient caucasiens. En moyenne, les participants étaient
âgés de 42 ans, fumaient 21 cigarettes par jour, et
présentaient 24 ans de tabagisme. Plus de 80 % avaient
déjà essayé d'arrêter au moins une fois, et 46 %
avaient déjà été exposés à un
traitement par substituts nicotiniques.
|
|

|
|
Tableau 1.. Caractéristiques initiales des participants.
|
|
|
Abstinence continue
Le taux d'abstinence continue de 4 semaines confirmée par la mesure
du monoxyde de carbone pendant les semaines 9 à 12 était
supérieur pour la varenicline (44,0 %) versus placebo (17,7 %)
(OR, 3,85; IC 95 %, 2,70-5,50; p < 0,001) et versus
bupropion LP (29,5 %) (OR, 1,93; IC 95 %, 1,40-2,68; p < 0,001)
(Figure 2). Le bupropion
LP était également supérieur au placebo (OR, 2,00; IC 95
%, 1,38-2,89; p < 0,001). Le taux d'abstinence continue des
semaines 9 à 24 était supérieur pour la varenicline (29,5
%) versus placebo (10,5 %) (OR, 3,68; IC 95 %, 2,42-5,60; p
< 0,001) et versus bupropion LP (20,7 %) (OR, 1,63; IC 95 %,
1,14-2,33; p = 0,007). Le taux d'abstinence continue des semaines 9
à 52 était significativement supérieur pour la
varenicline (21,9 %) comparé au placebo (8,4 %) (OR, 3,09; IC 95 %,
1,95-4,91; p < 0,001), mais n'était plus significatif
comparé au bupropion LP (16,1 %) (OR, 1,46; IC 95 %, 0,99-2,17;
p = 0,057) (Figure
2).
|
|

|
|
Figure 2.. Taux d'abstinence continue.
|
|
|
|
|

|
|
Figure 3.. Taux de prévalence d'abstinence de 7 jours.
|
|
|
Taux de prévalence d'abstinence
Les taux de prévalence de 7 jours d'abstinence étaient
significativement supérieurs pour la varenicline comparée au
placebo aux semaines 12, 24 et 52 (p < 0,001 à chaque
évaluation), et significativement supérieurs pour la varenicline
comparée au bupropion LP à la semaine 12 (p < 0,001)
et à la semaine 24 (p = 0,01)
(Figure 3).
Comparaisons en termes de sexe et de caractéristiques initiales
L'efficacité de la varenicline dans l'arrêt du tabac,
évaluée par le taux d'abstinence continue des semaines 9
à 12, était de 42,9 % pour les hommes et de 46 % pour les
femmes, sans différence entre eux comparé au placebo (hommes:
OR, 3,75; IC 95 %, 2,30-6,11; p < 0,001; et femmes: OR, 3,63; IC
95 %, 2,21-5,97; p < 0,001). Les analyses des autres
caractéristiques initiales en fonction des interactions de groupe de
traitement n'ont pas non plus montré de différences
significatives.
Effets sur le désir compulsif, le manque et la satisfaction liée au tabagisme
Les effets de la varenicline et du bupropion LP comparés au placebo,
sur le désir compulsif et le manque, mesurés par le MNWS et le
QSU-Brief, sont rapportés dans le
Tableau 2. Les
sous-scores du MNWS montraient que la varenicline et le bupropion LP
réduisaient tous deux significativement le désir de fumer et
l'affect négatif par rapport au placebo (p < 0,001). La
taille d'effet de la différence de la varenicline par rapport au
placebo représentait environ le double de celle du bupropion LP pour le
désir de fumer et était similaire au bupropion LP pour l'affect
négatif. La varenicline réduisait significativement l'agitation
(p = 0,01), mais avec une petite taille
d'effet.27
L'augmentation de l'appétit était significativement
supérieure avec la varenicline par rapport au placebo (p =
0,04), mais également avec une petite taille d'effet. Le bupropion LP
n'affectait pas l'agitation ni l'appétit, mais augmentait
significativement l'insomnie par rapport au placebo (p = 0,048).
|
|

|
|
Tableau 2.. Caractéristiques initiales des participants
|
|
|
Les résultats du QSU-Brief démontraient que,
comparé au placebo, le score total d'envie compulsive était
significativement inférieur pour la varenicline (p < 0,001)
et le bupropion LP (p = 0,001). La taille d'effet pour la varenicline
était moyenne par rapport au placebo, mais représentait environ
le double de celle du bupropion LP.
Les scores mCEQ indiquaient que, comparé au placebo, la varenicline
réduisait significativement la satisfaction procurée (p
< 0,001), la récompense psychologique (p < 0,001), le
plaisir des sensations olfactives (p < 0,001), et le soulagement
du désir compulsif (p < 0,001) après avoir
fumé, avec des tailles d'effet moyennes. Le bupropion LP
réduisait également significativement la récompense
psychologique comparé au placebo (p = 0,004), avec une taille
d'effet d'environ la moitié de celle de la varenicline
(Tableau 3).
|
|

|
|
Tableau 3.. Mesure du renforcement du tabagisme par le mCEQ : analyse de mesures répétées des données de lá semaine 1 a la semaine 7 pour les participants qui fumaient.
|
|
|
Poids corporel
Du fait que l'arrêt du tabac affecte le poids corporel, l'effet du
traitement attribué sur la variation pondérale était
analysé séparément pour les participants ayant
achevé la période de traitement et maintenu leur abstinence des
semaines 9 à 12. Pour ces participants, l'augmentation pondérale
moyenne (ET) en kilogrammes, entre l'inclusion et la semaine 12, était
de 2,37 (2,76) pour la varenicline, de 2,12 (1,80) pour le bupropion LP, et de
2,92 (3,94) pour le placebo.
Innocuité et tolérance
Sur les 1 025 participants, 1 022 ont pris au moins une dose du traitement
de l'étude et ont été inclus dans l'analyse de
tolérance. La varenicline était sans danger et
généralement bien tolérée. Les
événements indésirables recensés avec le
traitement incluaient ceux survenus jusqu'à 7 jours après la fin
du traitement; ils ont été rapportés chez au moins 5 %
des participants sous varenicline, avec une fréquence supérieure
par rapport au placebo (Tableau
4). L'incidence des événements
indésirables était similaire entre les groupes. L'arrêt du
traitement dû aux événements indésirables
était de 8,6 % pour la varenicline, de 15,2 % pour le bupropion LP, et
de 9,0 % pour le placebo. Les nausées, qui constituaient
l'événement indésirable le plus fréquent avec la
varenicline (28,1 %), étaient le plus souvent légères
à modérées, avec une diminution au cours du temps, et ont
entraîné peu d'arrêts du traitement (2,6 %). L'insomnie
était l'événement indésirable le plus
fréquent avec le bupropion LP (21,9 %).
|
|

|
|
Tableau 4.. Événements indésirables survenus lors du traitement (incluant ceux pas nécessairement liés au traitement de l'étude)*.
|
|
|
Quatorze cas d'événements indésirables graves ont
été rapportés pendant les 12 semaines de traitement ou
dans les 7 jours suivant la dernière prise. Pour la varenicline, ils
consistaient en douleurs abdominales, fibrillation auriculaire, pneumonie, et
possible AVC; pour le bupropion LP, ils consistaient en cholécystite et
Cchoc septique, céphalées et crise d'épilepsie
tonico-clonique; et pour le placebo, elles incluaient le cancer du poumon,
l'infarctus du myocarde aigu, la schizophrénie (poussée
évolutive), les douleurs thoraciques, l'infection urinaire, la
fibrillation auriculaire et les douleurs thoraciques (sous le bras). Deux de
ces 14 événements indésirables graves ont
été attribués au traitement de l'étude. Un
Caucasien de 75 ans recevant de la varenicline a reçu un diagnostic de
fibrillation auriculaire au jour 84, avec résolution au jour 85. Un
Caucasien de 47 ans sous bupropion LP a présenté une crise
d'épilepsie tonico-clonique au jour 20. Après avoir
été examiné au service des urgences, le participant a
été autorisé à sortir et l'événement
considéré comme résolu. Aucun décès n'est
survenu pendant la phase de traitement. Un participant assigné à
recevoir le placebo est décédé pendant le suivi
post-traitement de 40 semaines.
COMMENTAIRES
 |  |
Dans ce grand essai randomisé de phase 3, la varenicline a
démontré son efficacité dans l'arrêt du tabac. Le
vtaux d'abstinence continue à la fin de la phase de traitement
était près de 2,5 fois supérieur pour la varenicline
comparée au placebo; il était similaire pour les hommes et les
femmes, et se maintenait jusqu'à 24 et 52 semaines. La varenicline
était également plus efficace que le bupropion LP jusqu'à
24 semaines.
Le rôle potentiel des agonistes partiels dans le traitement des
addictions28,29
et le rôle primordial du sous-type  4β2 des nAChR dans la
dépendance à la nicotine ont constitué les fondements
théoriques du développement de la
varenicline.11 Les
agonistes partiels peuvent agir selon 2 mécanismes.
Premièrement, en activant partiellement les récepteurs 4β2 des nAChR dans la
dépendance à la nicotine ont constitué les fondements
théoriques du développement de la
varenicline.11 Les
agonistes partiels peuvent agir selon 2 mécanismes.
Premièrement, en activant partiellement les récepteurs
 4β2 du nAChR, ils peuvent atténuer le désir
compulsif et le syndrome de manque à la suite d'un arrêt brutal
ou d'une réduction de la consommation de nicotine. Deuxièmement,
en occupant une partie des récepteurs et en bloquant la liaison de la
nicotine, l'agoniste partiel peut également agir en tant qu'antagoniste
Cpartiel pour réduire la satisfaction procurée par le tabac,
avant l'arrêt ou après un écart ou une rechute. Ces deux
effets ont été observés dans le présent essai. Le
MNWS et le QSU-brief ont démontré une réduction
du désir compulsif et du syndrome de sevrage avec la varenicline. En
outre, le mCEQ a clairement démontré l'effet de la varenicline
dans la réduction de certains effets de récompense
associés au tabagisme. 4β2 du nAChR, ils peuvent atténuer le désir
compulsif et le syndrome de manque à la suite d'un arrêt brutal
ou d'une réduction de la consommation de nicotine. Deuxièmement,
en occupant une partie des récepteurs et en bloquant la liaison de la
nicotine, l'agoniste partiel peut également agir en tant qu'antagoniste
Cpartiel pour réduire la satisfaction procurée par le tabac,
avant l'arrêt ou après un écart ou une rechute. Ces deux
effets ont été observés dans le présent essai. Le
MNWS et le QSU-brief ont démontré une réduction
du désir compulsif et du syndrome de sevrage avec la varenicline. En
outre, le mCEQ a clairement démontré l'effet de la varenicline
dans la réduction de certains effets de récompense
associés au tabagisme.
Ce double effet pourrait être reflété dans
l'augmentation du taux de prévalence d'abstinence observé avec
la varenicline jusqu'à la semaine 5. Le taux de prévalence pour
le bupropion LP a atteint un plateau à 1 à 2 semaines, puis est
resté relativement stable pendant la phase de traitement. Cet effet
plateau rapidement atteint avec le bupropion LP s'accorde avec les
observations de précédents
essais.17
L'augmentation des taux d'abstinence tendant à être
observée au fil du temps avec la varenicline pourrait indiquer une
diminution des effets renforçants du tabac.
L'une des caractéristiques fondamentales du schéma de cette
étude était l'inclusion du bupropion, seul traitement sans
)nements indnicotine précédemment approuvé dans la
désintoxication tabagique, comme traitement actif de comparaison. La
comparaison avec un agent actif est particulièrement importante tandis
que la disponibilité de nouveaux composés pour l'arrêt du
tabac crée de nouvelles options thérapeutiques. Afin
d'éviter un biais négatif contre le bupropion, les individus qui
avaient déjà été exposés à cette
substance étaient exclus. Ainsi, toute différence
observée entre les traitements ne pouvait être affectée
par les participants qui avaient rechuté alors qu'ils avaient
été précédemment traités par bupropion.
Cette méthode permet une comparaison claire entre les deux
substances.
Cette étude n'aborde pas les effets de la varenicline sur les
fumeurs ayant un antécédent de traitement par bupropion. Dans la
mesure où certains fumeurs peuvent avoir pris du bupropion pour
arrêter de fumer ou pour traiter une dépression,
l'interprétation de ces résultats dans une plus large population
pourrait comporter certaines limites. De même, les fumeurs
généralement sains inclus dans cet essai peuvent ne pas
Cêtre représentatifs des fumeurs les plus susceptibles de
rechercher un traitement.
Le taux d'abstinence continue à la semaine 52 chez les participants
assignés à recevoir le bupropion LP était quelque peu
inférieur à celui observé dans les
précédentes études qui rapportaient des taux d'abstinence
continue de 52 semaines avec cette
substance.17,18
Cependant, les taux d'achèvement de cet essai étaient
comparables entre tous les groupes de traitement, et les taux de
réponse au placebo étaient similaires aux
précédentes études sur le bupropion
LP.17
Il est désormais reconnu que la dépendance à la
nicotine est une maladie chronique
récurrente.4
Bien que tous les participants aient continué à recevoir une
brève consultation d'aide tout au long de l'essai, les taux
d'abstinence ont diminué dans tous les groupes après la fin du
traitement, et une réduction des différences entre les groupes a e;té observée à 52 semaines. La recherche d'un
moyen d'améliorer ces résultats à plus long terme
constituera une prochaine étape fondamentale. Dans une étude
séparée chez des participants parvenus à l'abstinence
après 12 semaines de traitement ouvert par varenicline, un traitement
supplémentaire de 12 semaines par varenicline en double aveugle a
produit des taux d'abstinence à long terme supérieurs au
placebo.30
Bien que la varenicline ait montré son innocuité et une
tolérance généralement bonne, elle a induit des troubles
gastro-intestinaux et des troubles du sommeil plus fréquents que le
placebo. Cependant, les nausées, qui étaient
l'événement indésirable le plus fréquent pour la
varenicline, ont entraîné peu d'arrêts du traitement.
Globalement, le taux d'événements indésirables
était comparable entre tous les groupes. Les arrêts de traitement
liés à ces événements étaient comparables
dans les groupes varenicline et placebo (8,6 % versus 9,0 %), avec
une fréquence inférieure par rapport au groupe bupropion LP
(15,2 %).
CONCLUSIONS
La varenicline est un traitement efficace dans l'arrêt du tabac. Dans
cette étude, la varenicline présentait une efficacité
supérieure au placebo à tous les temps d'évaluation, et
supérieure au bupropion LP après 12 semaines de traitement,
ainsi qu'à 24 semaines. Par ailleurs, cette étude étaye
l'hypothèse suggérant qu'un agoniste partiel des
récepteurs nicotiniques de l'acétylcholine pourrait
réduire efficacement les envies compulsives et la satisfaction ou le
renforcement liés au tabagisme, et donne ainsi une nouvelle orientation
au développement de traitements destinés à l'arrêt
du tabac.
Informations sur les auteurs
Correspondance: David Gonzales, PhD, Smoking Cessation Center,
Department of Medicine, Oregon Health & Science University, 3181 SW Sam
Jackson Park Rd, CR 115, Portland, OR 97239
(gonzales{at}ohsu.edu).
Les affiliations des auteurs et les membres du Groupe d'étude de
phase III Varenicline sont indiqués à la fin de cet
article.
Contributions des auteurs: le Dr Gonzales a eu un accès
complet à toutes les données de l'étude et accepter la
responsabilité de l'intégrité des données et de
l'exactitude de l'analyse des données.
Conception et schéma de l'étude: Gonzales, Nides,
Billing, Watsky, Williams, Reeves.
Recueil des données: Gonzales, Rennard, Nides, Oncken,
Billing, Gong, Reeves.
Analyse et interprétation des données: Gonzales,
Rennard, Nides, Azoulay, Billing, Watsky, Gong, Williams, Reeves.
Rédaction du manuscrit: Gonzales, Rennard, Nides, Oncken,
Billing.
Revue critique du manuscrit: Gonzales, Rennard, Oncken, Azoulay,
Billing, Watsky, Gong, Williams, Reeves.
Analyse statistique: Gonzales, Billing.
Obtention du financement: Azoulay, Watsky, Reeves.
Aide administrative, technique et matérielle: Gonzales,
Rennard, Watsky, Williams.
Supervision de l'étude: Azoulay, Watsky, Gong, Reeves.
Liens financiers: le Dr Gonzales a déclaré avoir des
contrats de recherche avec Pfizer, Sanofi-Aventis, GlaxoSmithKline, et Nabi
Biopharmaceuticals; des honoraires de consultant et des honoraires de Pfizer,
Sanofi-Aventis et GlaxoSmithKline; il détient 5 actions chez Pfizer. Le
Dr Rennard a déclaré avoir eu et avoir un certain nombre de
relations avec des compagnies qui produisent et/ou ont des services concernant
la prise en charge ambulatoire de patients atteints de bronchopneumopathies
chronique obstructive. Ces relations incluent un travail de consultant chez
Adams, Almirall, Altana, Array Biopharma, AstraZeneca, Aventis, Biolipox,
Centocor, Dey, Critical Therapeutics, GlaxoSmithKline, Johnson & Johnson,
Merck, Novartis, OnoPharma, Otsuka, RJ Reynolds, Roche, Sankyo,
Schering-Plough, Scios et Wyeth; un travail consultatif pour des essais
cliniques chez Altana, Astra-Zeneca, Aventis, Centocor, GlaxoSmithKline,
Novartis, Pfizer, et Philip Morris; des interventions en tant qu'orateur dans
des programmes de FMC et la réalisation de travail de recherche
à la fois fondamentale et clinique pour Altana, Astra-Zeneca,
Boehringer Ingelheim, GlaxoSmithKline, et Novartis. Le Dr Nides rapporte avoir
reçu des bourses de recherche, des honoraires de consultant et des
honoraires de Pfizer, Sanofi-Aventis, et GlaxoSmithKline. Le Dr Oncken a
déclaré avoir reçu des bourses de recherche, des
honoraires de consultant et des honoraires de Pfizer, avoir reçu sans
frais des substitutifs nicotiniques et des placebos de GlaxoSmith-Kline pour
des études sur l'arrêt du tabac; et avoir reçu des
honoraires de Pri-Med. Les Drs Azoulay, Watsky, Gong, Williams et Reeves et Mr
Billing ont déclaré détenir des actions chez Pfizer ou
des stocks options chez Pfizer.
Financement/Soutien: cette étude a
bénéficié du soutien de Pfizer Inc, qui a fourni le
financement, le traitement à l'étude et le placebo ainsi que le
monitoring.
Rôle du sponsor: la base de données contenant les
observations des 19 investigateurs individuels a été
conservée par Pfizer Inc, et les analyses statistiques ont
été réalisées chez Pfizer Inc par Mr Billing et
Ann Pennington, MS.
Analyse statistique indépendante: Barbara Pizacani, PhD,
Adjunct Faculty at the School of Nursing at Oregon Health & Science
University (OHSU) and Epidemiologist in Program Design and Evaluation Services
for Multnomah Health Department and Orgeon Department of Human Services, et
Clyde Dent, PhD, du Program Design and Evaluation Services of Multnomah County
Health Department and Oregon Department of Human Services, ont eu accès
à toutes les données utilisées dans cette étude et
ont réalisé une analyse indépendante en consultation avec
le Dr Gonzales. L' analyse indépendante a répliqué les
analyses des critères de jugement primaires et secondaires
rapportées dans le manuscrit à l'aide de tableaux de croisement
des données, de régression logistique et de procédure de
modèles mixtes. Des répétitions des tableaux pour les
autres points ont été faites. Les résultats pour les
événements indésirables ont également
été répliqués. Les résultats ont
été comparables avec ceux obtenus par le sponsor. Il y avait
quelques différences, mais toutes ont été résolues
avant la soumission du manuscrit et aucune n'a affecté les
déductions faites dans le manuscrit. Une compensation a
été offerte pour les Drs Pizacani et Dent par OHSU. Pfizer Inc
n'est pas intervenu dans le financement de l'analyse indépendante.
Groupe d'étude de phase III Varenicline: Lirio S. Covey, PhD,
Social Psychiatry Research Institute, New York, NY; Jeffrey George Geohas, MD,
Radiant Research, Chicago, Ill; Elbert D. Glover, PhD, Department of Public
and Community Health, University of Maryland, College Park; Jon F. Heiser, MD,
Pharmacology Research Institute, Newport Beach, Calif; Kevin Lawrence Kovitz,
MD, Tulane University Health Sciences Center, New Orleans, La; Lawrence
Vincent Larsen, MD, PhD, Intermountain Clinical Research, Salt Lake City,
Utah; Myra Lee Muramoto, MD, University of Arizona Health Sciences, Tucson;
Barry Packman, MD, Radiant Research, Philadelphia, Pa; Victor Ivar Reus, MD,
University of California, San Francisco; Howard I. Schwartz, MD, Miami
Research Associates Inc, Miami, Fla; Arunabh Talwar, MD, North Shore
University Hospital, Great Neck, NY; Martin Lewis Throne, MD, Radiant
Research, Atlanta, Ga; Dan Louis Zimbroff, MD, Pacific Clinical Research
Medical Group, Upland, Calif.
Remerciements: nous remercions Wendy G. Bjornson, MPH, OHSU, pour sa
contribution au développement du manuscrit et Kelly Stein Marcus, PhD,
Cardinal Health, pour avoir fourni la revue médicale du contenu
éditorial et pour avoir aidé à incorporer les revues des
auteurs et à réaliser les tableaux et les figures.
Affiliations des auteurs: Smoking Cessation Center, Department of
Medicine, Oregon Health & Science University, Portland (Dr Gonzales);
Pulmonary Division, University of Nebraska Medical Center, Omaha (Dr Rennard);
Los Angeles Clinical Trials, Los Angeles, Calif (Dr Nides); Department of
Medicine, University of Connecticut Health Center, Farmington (Dr Oncken);
Pfizer Global Research and Development, Groton, Conn (Drs Azoulay, Watsky,
Gong, Williams, et Reeves et Mr Billing).
BIBLIOGRAPHIE
 |  |
1. Centers for Disease Control and Prevention. Cigarette smoking among adults—United States, 2002. MMWR Morb Mortal Wkly Rep. 2004; 53:427-431.
PUBMED
2. American Psychiatric Association. Diagnostic and
Statistical Manual of Mental Disorders. Fourth Edition, Revised.
Washington, DC: American Psychiatric Association;2000
.3. Shiffman S, West R, Gilbert D. Recommendation for the assessment of
tobacco craving and withdrawal in smoking cessation trials.
Nicotine Tob Res. 2004;6
: 599-614.
ABSTRACT
4. Fiore MC, Bailey WC, Cohen SJ, et al. Treating Tobacco
Use and Dependence: Quick Reference Guide for Clinicians.
Rockville, Md: US Dept of Health and Human Services, Public Health Service;2000
.5. Maskos U, Molles BE, Pons S, et al. Nicotine reinforcement and
cognition restored by targeted expression of nicotinic receptors.
Nature. 2005; 436:103
-107.
PUBMED
6. Di Chiara G. Role of dopamine in the behavioural actions of
nicotine related to addiction. Eur J Pharmacol.2000; 393:295
-314.
PUBMED
7. Tapper AR, McKinney SL, Nashmi R, et al. Nicotine activation of
alpha4* receptors: sufficient for reward, tolerance, and
sensitization. Science. 2004;306
: 1029-1032.
FREE FULL TEXT
8. Pontieri FE, Tanda G, Orzi F, Di Chiara G. Effects of nicotine on
)s au traitement de lthe nucleus accumbens and similarity to those of addictive drugs.
Nature. 1996; 382:255
-257.
PUBMED
9. Papke RL, Heinemann SF. Partial agonist properties of cytisine on
neuronal nicotinic receptors containing the beta 2 subunit. Mol
Pharmacol. 1994; 45:142
-149.
ABSTRACT
10. Scharfenberg G, Benndorf S, Kempe G. Cytisine (Tabex) as a
pharmaceutical aid in stopping smoking [in German]. Dtsch
Gesundheitsw. 1971; 26:463
-465.
PUBMED
11. Coe JW, Brooks PR, Wirtz MC, et al. 3,5-Bicyclic aryl piperidines:
a novel class of alpha4beta2 neuronal nicotinic receptor partial agonists fobr
smoking cessation. Bioorg Med Chem Lett.2005; 15:4889
-4897.
PUBMED
12. Jorenby DE, Hays JT, Rigotti NA, et al; for the Varenicline Phase 3
Study Group. Efficacy of varenicline, an 42 nicotinic acetylcholine receptor
partial agonist, vs placebo or sustained-release bupropion for smoking
cessation: a randomized controlled trial. JAMA.2006; 296:56
-63.
FREE FULL TEXT
13. Gonzales DH, Nides MA, Ferry LH, et al. Bupropion SR as an aid to
smoking cessation in smokers treated previously with bupropion: a randomized
placebo-controlled study. Clin Pharmacol Ther.2001; 69:438
-444.
PUBMED
14. National Cancer Institute. Clearing the Air: Quit
Smoking Today. Washington, DC: National Institutes of Health;2003
. NIH publication 03-1647.15. Fiore MC. Treating tobacco use and dependence: an introduction to
the US Public Health Service Clinical Practice Guideline. Respir
Care. 2000; 45:1196
-1199.
PUBMED
16. Heatherton TF, Kozlowski LT, Frecker RC, Fagerström KO. The
Fagerström Test for Nicotine Dependence: a revision of the
Fagerström Tolerance Questionnaire. Br J Addict.1991; 86:1119
-1127.
PUBMED
17. Jorenby DE, Leischow SJ, Nides MA, et al. A controlled trial of
sustained-release bupropion, a nicotine patch, or both for smoking cessation.N Engl J Med. 1999;340
: 685-691.
PUBMED
18. Tønnesen P, Tonstad S, Hjalmarson A, et al. Amulticentre,
randomized, double-blind, placebocontrolled, 1-year study of bupropion SR for
smoking cessation. J Intern Med. 2003;254
: 184-192.
PUBMED
19. Hughes JR, Hatsukami D. Signs and symptoms of tobacco withdrawal.
Arch Gen Psychiatry. 1986;43
: 289-294.
FREE FULL TEXT
20. Cappelleri JC, Bushmakin AG, Baker CL, Merikle E, Olufade AO,
Gilbert DG. Revealing the multidimensional framework of the Minnesota nicotiCne
withdrawal scale. Curr Med Res Opin.2005; 21:749
-760.
PUBMED
21. Cox LS, Tiffany ST, Christen AG. Evaluation of the brief
questionnaire of smoking urges (QSU-brief) in laboratory and clinical
settings. Nicotine Tob Res. 2001;3
: 7-16.
ABSTRACT
22. Cappelleri JC, Bushmakin AG, Baker CL, et al. Confirmatory
validation of the brief questionnaire of smoking urges. Value
Health. 2005; 8:334
.
23. Brauer LH, Behm FM, Lane JD, Westman EC, Perkins C, Rose JE. Individual differences in smoking reward from denicotinized cigarettes.Nicotine Tob Res. 2001;3: 101-109.
ABSTRACT
24. Rose JE, Behm FM, Westman EC. Nicotinemecamylamine treatment for
smoking cessation: the role of pre-cessation therapy. Exp Clin
Psychopharmacol. 1998; 6:331
-343.
PUBMED
25. Cappelleri JC, Bushmakin AG, Baker CL, et al. Confirmatory factor
analysis and reliability of the "smoking effects inventory."
Value Health. 2005;8
: 333.
26. Nides M, Oncken C, Gonzales D, et al. Smoking cessation with
varenicline, a selective alpha4beta2 nicotinic receptor partial agonist:
results from a 7-week, randomized, placebo- and bupropion-controlled trial
with one-year follow-up. Arch Intern Med. In
press.27. Cohen J. Statistical Power for the Behavioral
Sciences. 2nd ed. Hillsdale, NJ: Erlbaum;1988
.28. Jasinski DR, Pevnick JS, Griffith JD. Human pharmacology and abuse
potential of the analgesic buprenorphine: a potential agent for treating
narcotic addiction. Arch Gen Psychiatry.1978; 35:501
-516.
FREE FULL TEXT
29. Vocci FJ, Acri J, Elkashef A. Medication development for addictive
disorders: the state of the science. Am J Psychiatry.2005; 162:1432
-1440.
FREE FULL TEXT
30. Tonstad S, Tønnesen P, Hajek P, Williams KE, Billing CB,
Reeves KR; for the Varenicline Phase 3 Study Group. Effect of maintenance
therapy with varenicline on smoking cessation: a randomized controlled trial.
JAMA. 2006; 296:64
-71.
FREE FULL TEXT
ARTICLES EN RAPPORT
EFFICACITÉ DE LA VARÉNICLINE, UN AGONISTE PARTIEL DES RÉCEPTEURS A4B2 DE L'ACÉTYLCHOLINE NICOTINIQUE VS PLACEBO OU BUPROPION À LIBÉRATION PROLONGÉE DANS LA CESSATION DU TABAGISME: ESSAI RANDOMISÉ ET COMPARATIF
Douglas E. Jorenby, J. Taylor Hays, Nancy A. Rigotti, Salomon Azoulay, Eric J. Watsky, Kathryn E. Williams, Clare B. Billing, Jason Gong, Karen R. Reeves, et pour le groupe d'étude de phase III Varénicline
JAMA. 2006;296:56.
Résumé
EFFET D'UN TRAITEMENT D'ENTRETIEN PAR VARÉNICLINE SUR L'ARRÊT DU TABAGISME: ESSAI RANDOMISÉ ET COMPARATIF
Serena Tonstad, Philip Tønnesen, Peter Hajek, Kathryn E. Williams, Clare B. Billing, Karen R. Reeves, et pour le groupe d'étude de phase III varénicline
JAMA. 2006;296:64.
Résumé
JAMA. 2006;296:9.
Texte Complet
|